ВИСКОМЕТР ВК 2000 | Madar Yara
Код товара:
VK-2000
Особенности:
АВТОМАТИЗИРОВАННЫЙ ВИСКОМЕТР КРЕБСА VK2000
Первый полностью автоматический вискозиметр KREBS. Не нужно опускать ни одну ручку!
Инструмент, основанный на традиционном методе KREBS: постоянная уникальная скорость (200 об/мин) и уникальный вращающийся шпиндель. Микропроцессор автоматически преобразует измерение, которое постоянно отображается в выбранных единицах измерения: KU, go o cP. VK 2000 позволяет пользователю выбирать между двумя различными методами работы: ручным и автоматическим. Если выбран ручной режим, пользователь может выбрать любой тип контейнера для выполнения измерений.
В ручном режиме клавиши ВВЕРХ и ВНИЗ перемещают шпиндель в нужное положение. Нажмите СТАРТ и СТОП, чтобы начать измерение и остановить вращение двигателя. Автоматический режим позволяет выбирать и изменять с помощью клавиатуры 2 параметра: SampleWaitingTime -SWT (время, в течение которого шпиндель остается погруженным в образец до начала вращения) и SampleMeasuringTime –SMT- (время вращения шпинделя, погруженного в образец).
Вискозиметр MYR KREBS VK2000 используется для измерения вязкости красок, покрытий, чернил, клеев и паст как в производственном процессе, так и в лабораторном контроле качества.
Технические характеристики:
ДИАПАЗОН ВЯЗКОСТИ
| ЕДИНИЦА | Диапазон | Разрешение |
|---|---|---|
| КУ | 40,2- 141 | 0,1 КУ |
| г | 32- 1.099 | 1,0 Г |
| КП | 27 -5,274 | 5 сП |
| Точность | ± 1% полной шкалы (FSR) | |
| Повторяемость | ± 0,2% |
ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
| Сеть | 100–240 В/50–60 Гц |
|---|---|
| Рабочая температура | +10°С — +40° |
| Вес | 8,5 кг |
| Класс защиты | IP20 |
ХАРАКТЕРИСТИКИ
| Определение вязкости | КУ,г или КП |
|---|---|
| Скорость | 200 об/мин |
| Шпиндель | стандартный шпиндель типа KREBS |
| Однонаправленный интерфейс RS232 | При использовании вместе с последовательным принтером выдает распечатанный билет, отвечающий требованиям хранения данных в контроле качества |
Базовая поставка включает 9 шт. 0003
0003
| — Вискозиметр — Штатив со шпинделем типа Кребса — Набор адаптеров уровня (1/2 пинты и 1 пинта) | — Стандартный стеклянный стакан — Сертификат калибровки — Руководство пользователя |
SERIAL PRINTER
PASTE SPINDLE
Related Products
LAB Equipment
- Balance
- Bath
- C.O.D meter
- Centrifuge
- Chamber
- Colony counter
- kalorimetre
- Density meter
- Flame Photometer
- Heating mantle
- Hot plate
- Ice Maker
- Incubator
- Kjeldahl analyzer
- Melting Point Apparatus
- Muffle Furnace
- Microwave Reaction System
- oven
- Hand Рефрактометр
- Концентрация образца
- Шейкер
- Спектрофотометр
- Ультразвуковой очиститель
- Вискозиметр
- Water distiller
- Water purification system
- pH & Conductivity Meter
- Hotplate Stirrers
- Rotary Evaporator
- Mixer & Rotator
- Homogeniser
- Overhead Stirrers
- Recirculating Cooler
- Ultrasonic Processor
- Gas Meter and Detectors
- Цифровой рефрактометр
- Настольный рефрактометр
- Поляриметр
- Регистратор данных
Структура комплекса TnsB-транспозаза-ДНК типа V-K CRISPR-ассоциированного транспозона
. 2022 2 октября; 13 (1): 5792.
2022 2 октября; 13 (1): 5792.
doi: 10.1038/s41467-022-33504-5.
Франсиско Тенхо-Кастаньо 1
, Николас Софос 1 , Бланка Лопес-Мендес 2 , Луиза С. Штуцке 1 , Андерс Фульсанг 1 , Стефано Стелла 1 3 , Гильермо Монтойя 4Принадлежности
- 1 Группа структурной молекулярной биологии, Центр исследований белков Фонда Ново Нордиск, факультет здравоохранения и медицинских наук Копенгагенского университета, 2200, Копенгаген, Дания.
- 2 Центр очистки и характеристики белков, Центр исследований белков Фонда Ново Нордиск, факультет здравоохранения и медицинских наук Копенгагенского университета, 2200, Копенгаген, Дания.

- 3 Twelve Bio ApS, Ole Maaløes Vej 3, 2200, Копенгаген, Дания.
- 4 Группа структурной молекулярной биологии, Центр исследований белков Фонда Ново Нордиск, факультет здравоохранения и медицинских наук Копенгагенского университета, 2200, Копенгаген, Дания. [email protected].
- PMID: 36184667
- PMCID: PMC9527255
- DOI: 10.1038/с41467-022-33504-5
Бесплатная статья ЧВК
Франсиско Тенхо-Кастаньо и др.
Нац коммун. .
.
Бесплатная статья ЧВК
. 2022 2 октября; 13 (1): 5792.
doi: 10.1038/s41467-022-33504-5.
Авторы
Франсиско Тенхо-Кастаньо 1 , Николас Софос 1 , Бланка Лопес-Мендес 2 , Луиза С. Штуцке
Принадлежности
- 1 Группа структурной молекулярной биологии, Центр исследований белков Фонда Ново Нордиск, факультет здравоохранения и медицинских наук Копенгагенского университета, 2200, Копенгаген, Дания.

- 2 Центр очистки и характеристики белков, Центр исследований белков Фонда Ново Нордиск, факультет здравоохранения и медицинских наук Копенгагенского университета, 2200, Копенгаген, Дания.
- 3 Twelve Bio ApS, Ole Maaløes Vej 3, 2200, Копенгаген, Дания.
- 4 Группа структурной молекулярной биологии, Центр исследований белков Фонда Ново Нордиск, факультет здравоохранения и медицинских наук Копенгагенского университета, 2200, Копенгаген, Дания. [email protected].
- PMID: 36184667
- PMCID: PMC9527255
- DOI:
10.
 1038/с41467-022-33504-5
1038/с41467-022-33504-5
Абстрактный
 В совокупности структурные особенности предполагают, что катализ связан со сборкой белок-ДНК для обеспечения правильной интеграции ДНК. Мутанты ДНК-связывающего остатка показывают, что отсутствие специфичности снижает активность, но в некоторых случаях может увеличивать транспозицию. Наша структура проливает свет на реакцию переноса цепи DDE-транспозаз и предлагает новое понимание транспозиции CAST.
В совокупности структурные особенности предполагают, что катализ связан со сборкой белок-ДНК для обеспечения правильной интеграции ДНК. Мутанты ДНК-связывающего остатка показывают, что отсутствие специфичности снижает активность, но в некоторых случаях может увеличивать транспозицию. Наша структура проливает свет на реакцию переноса цепи DDE-транспозаз и предлагает новое понимание транспозиции CAST.© 2022. Автор(ы).
Заявление о конфликте интересов
Г.М. и S.S. являются соучредителями и членами Twelve Bio BoD. Остальные авторы заявляют об отсутствии конкурирующих интересов.
Цифры
Рис. 1. Крио-ЭМ структура CAST…
Рис.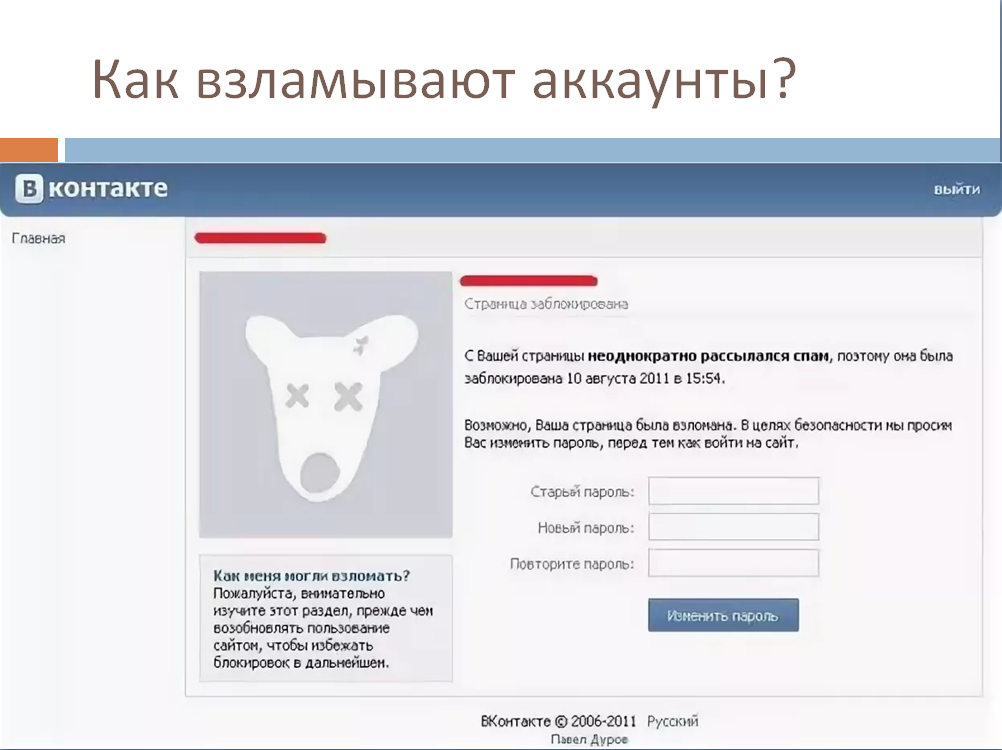 1. Крио-ЭМ структура субъединицы CAST shTnsB, представляющая посткаталитическое состояние…
1. Крио-ЭМ структура субъединицы CAST shTnsB, представляющая посткаталитическое состояние…
a Общая схема реакции интеграции транспозаз семейства TnsB. Активный центр DDE катализирует атаку H 2 O на концах транспозона. Прямая атака 3’ОН груза ДНК на сайт ДНК-мишени приводит к образованию комплекса переноса цепи (STC). Промежуточное соединение Шапиро разрешается путем репликации с образованием дупликации сайта-мишени и коинтеграта, которые могут быть разрешены с помощью RecA или резольвазы. b Архитектура белка shTnsB. c Карта плотности крио-ЭМ с глобальным разрешением 2,46 Å TnsB (STC) в посткаталитическом состоянии (см. Также дополнительные рисунки 6–7, дополнительную таблицу 2). Карта окрашена в соответствии с карикатурой, описывающей строение на панели d . д Мультфильм ШТнсБ-СТЦ. Комплекс состоит из 4 протомеров shTnsB и 6 олигонуклеотидов ДНК, представляющих посткаталитическое состояние STC (панель a ). С этой точки зрения целевая ДНК расположена вверху структуры, а более длинные концы транспозона расположены внизу. На схеме отмечены непереносимая цепь (NTS) и переносимая цепь (TS) транспозона. Пунктирные линии изображают взаимодействие между MD и NTD1 из-за кривизны ветвей ДНК. e Ленточная схема, показывающая обзор сборки ШТнсБ-СТЦ.
д Мультфильм ШТнсБ-СТЦ. Комплекс состоит из 4 протомеров shTnsB и 6 олигонуклеотидов ДНК, представляющих посткаталитическое состояние STC (панель a ). С этой точки зрения целевая ДНК расположена вверху структуры, а более длинные концы транспозона расположены внизу. На схеме отмечены непереносимая цепь (NTS) и переносимая цепь (TS) транспозона. Пунктирные линии изображают взаимодействие между MD и NTD1 из-за кривизны ветвей ДНК. e Ленточная схема, показывающая обзор сборки ШТнсБ-СТЦ.
Рис. 2. Архитектура комплекса ШТнсБ-СТЦ.
Рис. 2. Архитектура комплекса ШТнсБ-СТЦ.
a На верхней панели показана схема…
Рис. 2. Архитектура комплекса ШТнсБ-СТЦ. a На верхней панели показана схема мобильного элемента S. hofmannii с левым и правым концами (LE и RE) с каждой стороны груза ДНК. Сильный цветовой тон показывает область каждого элемента, присутствующего в структуре. Нижняя панель не включает белковые фрагменты в структуру и показывает ДНК STC. ДНК окрашена по верхней схеме для LE и RE, а участок ДНК-мишени показан серым цветом. Желтые точки указывают сайт, где произошла прямая атака 3′-ОН на ДНК-мишень, чтобы способствовать реакции переноса цепи. b Детальный вид ассоциации протомера shTnsB с ДНК STC. Две различные ассоциации наблюдаются для молекул shTnsB. Различные участки ДНК, взаимодействующие с белками, показаны соответствующим ярким цветовым оттенком. c Подробное изображение спиральных доменов NTD1 и 2, демонстрирующее специфические взаимодействия с основаниями ДНК в области LTR(6). Маркировка нуклеотидов соответствует цветовому коду на рис. 1d, e (см. также рис. 1d и дополнительный рис. 8).
hofmannii с левым и правым концами (LE и RE) с каждой стороны груза ДНК. Сильный цветовой тон показывает область каждого элемента, присутствующего в структуре. Нижняя панель не включает белковые фрагменты в структуру и показывает ДНК STC. ДНК окрашена по верхней схеме для LE и RE, а участок ДНК-мишени показан серым цветом. Желтые точки указывают сайт, где произошла прямая атака 3′-ОН на ДНК-мишень, чтобы способствовать реакции переноса цепи. b Детальный вид ассоциации протомера shTnsB с ДНК STC. Две различные ассоциации наблюдаются для молекул shTnsB. Различные участки ДНК, взаимодействующие с белками, показаны соответствующим ярким цветовым оттенком. c Подробное изображение спиральных доменов NTD1 и 2, демонстрирующее специфические взаимодействия с основаниями ДНК в области LTR(6). Маркировка нуклеотидов соответствует цветовому коду на рис. 1d, e (см. также рис. 1d и дополнительный рис. 8).
Рис. 3. Сборка протомеров shTnsB.
3. Сборка протомеров shTnsB.
Рис. 3. Сборка протомеров shTnsB.
a Обзор архитектуры ШТнсБ…
Рис. 3. Сборка протомеров shTnsB.a Обзор архитектуры протомеров shTnsB и взаимодействий между двумя типами конформаций, наблюдаемых для белка на одной из ветвей ДНК STC (прозрачно). Цветные овалы обозначают увеличенные области на других панелях. b , c Подробное изображение взаимодействия OD shTnsB3 с доменами NTD2 и DDE shTnsB1 и 2 соответственно. d Увеличение области LTR(6), изображающее ассоциацию N-концевого β-листа NTD1 с MD shTnsB3.
Рис. 4. Каталитический центр ДДЭ…
Рис. 4. Каталитический центр ДДЕ shTnsB.
4. Каталитический центр ДДЕ shTnsB.
a В окруженной области находится один из…
Рис. 4. Каталитический центр ДДЕ shTnsB. a В области, обведенной кружком, находится один из каталитических центров в комплексе shTnsB-STC. Увеличение области показывает конформацию каталитического центра после катализа. Предполагаемая молекула воды и расстояния до соседних каталитических остатков и ДНК показаны в Å. б Наложение доменов DDE двух конформаций, обнаруженных в комплексе белок-ДНК для shTnsB. c Суперпозиция доменов DDE shTnsB2 и 3 с ecTnsB (PDB: 7PIK) и основным доменом MuA (PDB: 1BCO). СКО для суперпозиции находятся в диапазоне от 0,7 до 1,2 Å для 160 и 250 Cα. d Нижняя панель показывает, что, несмотря на высокое структурное сходство доменов DDE, единственной субъединицей во всех этих структурах, которая демонстрирует компетентный каталитический карман, является shTnsB2, которая является единственной, связанной с ДНК.
Рис. 5. Сравнение ДНК-связывающих доменов…
Рис. 5. Сравнение ДНК-связывающих доменов shTnsB, ecTnsB и MuA.
ДНК-связывающие домены…
Рис. 5. Сравнение ДНК-связывающих доменов shTnsB, ecTnsB и MuA.ДНК-связывающие домены трех различных транспозаз показаны выровненными на ДНК (PDB: 8AA5, 7PIK и 4FCY соответственно). В случае MuA показаны одни и те же домены, связанные с разными повторами. Для shTnsB были построены только домены протомеров 1 и 2. В случае ecTnsB изображен ДНК-связывающий домен одной из субъединиц концевого комплекса транспозона.
Рис. 6. Анализ комплексов переноса цепи…
Рис. 6. Анализ комплексов переноса цепи shTnsB и MuA.
6. Анализ комплексов переноса цепи shTnsB и MuA.
а ШТнсБ-СТЦ и…
Рис. 6. Анализ комплексов переноса цепи shTnsB и MuA.a Комплексы shTnsB-STC и MuA-STC показаны в той же цветовой схеме, что и на рис. 1, за исключением ДНК, окрашенной в белый цвет. b Обведенные кружками области на обоих комплексах сравниваются, чтобы показать ключевые различия в сборке комплексов STC.
Рис. 7. Анализ транспозиции in vivo и…
Рис. 7. Анализ транспозиции in vivo и количественная оценка методом ПЦР.
a Транспонирование было выполнено…
Рис. 7. Анализ транспозиции in vivo и количественная оценка методом ПЦР. a Транспозицию проводили путем трансформации бактерий плазмидой, содержащей сайт-мишень, показанный зеленым цветом, распознаваемым Cas12k:sgRNA (pTarget), плазмидой, содержащей донорную ДНК с последовательностями CAST RE и LE, показанными красным (pDonor ) и плазмиду, содержащую кодирующие последовательности sgRNA, Cas12k, TnsC, TniQ и TnsB (pHelper). Интеграцию донорной последовательности в pTarget количественно определяли с помощью количественной ПЦР с использованием набора праймеров, амплифицирующих область pTarget, в которой не происходит транспозиции (PF 9).0405-мишень и PR -мишень ) и набор праймеров, которые амплифицируют область между последовательностями LE-мишени и донора (продукт PF и продукт PR ). b Положение выбранных аминокислот в STC, подлежащих мутации и тестированию на транспозиционную активность. c Кратность изменения активности, измеренная с помощью количественной ПЦР для каждого мутанта TnsB. Для каждого мутанта проводили две или три биологические повторности. Отдельные точки данных, представляющие все технические повторы, обозначены точками. Столбцы представляют собой среднее значение кратности изменения активности, а усы, расположенные вокруг него, представляют собой стандартное отклонение. Активность дикого типа представлена пунктирной линией. Данные предоставляются в виде файла исходных данных.
Интеграцию донорной последовательности в pTarget количественно определяли с помощью количественной ПЦР с использованием набора праймеров, амплифицирующих область pTarget, в которой не происходит транспозиции (PF 9).0405-мишень и PR -мишень ) и набор праймеров, которые амплифицируют область между последовательностями LE-мишени и донора (продукт PF и продукт PR ). b Положение выбранных аминокислот в STC, подлежащих мутации и тестированию на транспозиционную активность. c Кратность изменения активности, измеренная с помощью количественной ПЦР для каждого мутанта TnsB. Для каждого мутанта проводили две или три биологические повторности. Отдельные точки данных, представляющие все технические повторы, обозначены точками. Столбцы представляют собой среднее значение кратности изменения активности, а усы, расположенные вокруг него, представляют собой стандартное отклонение. Активность дикого типа представлена пунктирной линией. Данные предоставляются в виде файла исходных данных.
Рис. 8. Альтернативный механизм РНК-управляемой интеграции…
Рис. 8. Альтернативный механизм РНК-управляемой интеграции в системе CAST типа V-K.
ShTnsC связывается с ДНК…
Рис. 8. Альтернативный механизм РНК-управляемой интеграции в системе CAST типа V-K. ShTnsC связывается с ДНК, образуя филаменты, которые деполимеризуются с помощью shTnsB (слева). Учитывая взаимодействия shTnsC с shTnsB и shCas12k-shTniQ, возникают две возможности (штриховые квадраты). Во-первых, shTnsC, связанный с shTnsB, может рекрутироваться с помощью нацеливающего комплекса, включающего shCas12k и shTniQ (верхний пунктирный квадрат). Во-вторых, shTnsC может сначала связываться с нацеливающим комплексом, а затем рекрутировать shTnsB (нижний пунктирный квадрат). Обе возможности продуцируют комплекс перед транспозицией, активирующий активность интегразы shTnsB и приводящий к вставке транспозона.
Обе возможности продуцируют комплекс перед транспозицией, активирующий активность интегразы shTnsB и приводящий к вставке транспозона.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Механизм рекрутирования и интеграции транспозонов, связанных с CRISPR, выявлен с помощью крио-ЭМ.
Пак Дж.У., Цай А.В., Чен Т.Х., Питерс Дж.Е., Келлогг Э.Х. Пак Ю и др. Proc Natl Acad Sci U S A. 2022 Aug 9;119(32):e22025. doi: 10.1073/pnas.22025. Epub 2022 1 августа. Proc Natl Acad Sci U S A. 2022. PMID: 35914146 Бесплатная статья ЧВК.
Выбор и ремоделирование целевого сайта с помощью систем CRISPR-транспозонов типа V.
Кверкес И., Шмитц М., Оберли С.
 , Чанез С., Джинек М.
Querques I и др.
Природа. 2021 ноябрь;599(7885):497-502. doi: 10.1038/s41586-021-04030-z. Epub 2021 10 ноября.
Природа. 2021.
PMID: 34759315
Бесплатная статья ЧВК.
, Чанез С., Джинек М.
Querques I и др.
Природа. 2021 ноябрь;599(7885):497-502. doi: 10.1038/s41586-021-04030-z. Epub 2021 10 ноября.
Природа. 2021.
PMID: 34759315
Бесплатная статья ЧВК.Структурная основа для сборки CRISPR-ассоциированного комплекса транспозонов типа V.
Шмитц М., Керкес И., Оберли С., Чанез С., Джинек М. Шмитц М. и соавт. Клетка. 2022 22 декабря;185(26):4999-5010.e17. doi: 10.1016/j.cell.2022.11.009. Epub 2022 25 ноября. Клетка. 2022. PMID: 36435179 Бесплатная статья ЧВК.
Структурная основа распознавания концов транспозонов объясняет центральные особенности систем транспозиции Tn7.
Качмарска З., Чарноцки-Цечура М., Гурекка-Минаковска К.М., Винго Р.Дж., Яцкевич Дж., Зайко В.
 , Познански Дж.Т., Равски М., Грант Т., Петерс Дж.Е., Новотны М.
Качмарска З. и др.
Мол Ячейка. 2022, 21 июля; 82(14):2618-2632.e7. doi: 10.1016/j.molcel.2022.05.005. Epub 2022 1 июня.
Мол Ячейка. 2022.
PMID: 35654042
Бесплатная статья ЧВК.
, Познански Дж.Т., Равски М., Грант Т., Петерс Дж.Е., Новотны М.
Качмарска З. и др.
Мол Ячейка. 2022, 21 июля; 82(14):2618-2632.e7. doi: 10.1016/j.molcel.2022.05.005. Epub 2022 1 июня.
Мол Ячейка. 2022.
PMID: 35654042
Бесплатная статья ЧВК.Tn5 как модель для понимания транспозиции ДНК.
Резников В.С. Резников В.С. Мол микробиол. 2003 март; 47(5):1199-206. doi: 10.1046/j.1365-2958.2003.03382.x. Мол микробиол. 2003. PMID: 12603728 Обзор.
Посмотреть все похожие статьи
Цитируется
Первые полные изображения управляемой CRISPR системы для вставки генов.
Барабас О, Райс Пенсильвания. Барабас О. и др. Природа. 2023 янв;613(7945):634-635.
 doi: 10.1038/d41586-022-04584-6.
Природа. 2023.
PMID: 36631579
Аннотация недоступна.
doi: 10.1038/d41586-022-04584-6.
Природа. 2023.
PMID: 36631579
Аннотация недоступна.
использованная литература
- Макарова К.С., и соавт. Эволюционная классификация систем CRISPR-Cas: взрыв класса 2 и производные варианты. Нац. Преподобный Микробиолог. 2020;18:67–83. doi: 10.1038/s41579-019-0299-x. — DOI — ЧВК — пабмед
- Дудна Я.
 А. Перспективы и задачи терапевтического редактирования генома. Природа. 2020; 578: 229–236. doi: 10.1038/s41586-020-1978-5.
—
DOI
—
ЧВК
—
пабмед
А. Перспективы и задачи терапевтического редактирования генома. Природа. 2020; 578: 229–236. doi: 10.1038/s41586-020-1978-5.
—
DOI
—
ЧВК
—
пабмед
- Дудна Я.
- Фор Г. и др. CRISPR-Cas в мобильных генетических элементах: контрзащита и не только. Нац. Преподобный Микробиолог. 2019;17:513–525. doi: 10.1038/s41579-019-0204-7. — DOI — пабмед
- Петерс Ю.

- Петерс Ю.


 1038/с41467-022-33504-5
1038/с41467-022-33504-5 , Чанез С., Джинек М.
Querques I и др.
Природа. 2021 ноябрь;599(7885):497-502. doi: 10.1038/s41586-021-04030-z. Epub 2021 10 ноября.
Природа. 2021.
PMID: 34759315
Бесплатная статья ЧВК.
, Чанез С., Джинек М.
Querques I и др.
Природа. 2021 ноябрь;599(7885):497-502. doi: 10.1038/s41586-021-04030-z. Epub 2021 10 ноября.
Природа. 2021.
PMID: 34759315
Бесплатная статья ЧВК. doi: 10.1038/d41586-022-04584-6.
Природа. 2023.
PMID: 36631579
Аннотация недоступна.
doi: 10.1038/d41586-022-04584-6.
Природа. 2023.
PMID: 36631579
Аннотация недоступна. А. Перспективы и задачи терапевтического редактирования генома. Природа. 2020; 578: 229–236. doi: 10.1038/s41586-020-1978-5.
—
DOI
—
ЧВК
—
пабмед
А. Перспективы и задачи терапевтического редактирования генома. Природа. 2020; 578: 229–236. doi: 10.1038/s41586-020-1978-5.
—
DOI
—
ЧВК
—
пабмед