Как добавить второй аккаунт в Вк в 2023 году
27 ноября Инструкции по соц-сетям
Содержание:
Наличие двух учетных записей в «Вконтакте» актуально для людей, ведущих бизнес, а также владельцев нескольких гаджетов, когда одному пользователю необходимо несколько страниц ВК. Создание дубликата ограничивается требованиями, которые нужно соблюдать.
Можно ли создать две страницы ВК на один номер
Создание второй учетной записи на один мобильный контакт возможно после изменения настроек в профиле уже действующей. Регистрация с привязкой того же номера системой распознается, как вход в уже созданный профиль. В этом случае Вконтакте автоматически перенаправляет на эту страницу. При этом в верхней части учетной записи появится соответствующее уведомление.
ВНИМАНИЕ! Мобильный номер прикрепляется к странице владельца для защиты безопасности данных. Создавать несколько аккаунтов с одним контактом не рекомендуется — есть риск попадания информации в руки третьих лиц.
Правила Вконтакте о нескольких аккаунтах для одного человека
Сервис рекомендует следовать следующим правилам при создании одним пользователем нескольких страниц:
- Не выполнять перепривязку контакта без острой необходимости. Это убережет данные от попадания к злоумышленникам.
- Перепривязка номера доступна ограниченное количество раз.
 При исчерпании лимита возникнут затруднения с использованием контакта в очередном профиле.
При исчерпании лимита возникнут затруднения с использованием контакта в очередном профиле. - Многократная привязка/перепривязка номера, как и использование его друзьями и родственниками владельца приведет к его откреплению и дальнейшим проблемам при использовании аккаунта.
ВАЖНО! Одни и те же мобильные данные в разных учетных записях могут привести к временной или постоянной блокировке. Процедура исполняется службой безопасности соцсети, если созданные страницы будут расценены, как спам-аккаунты.
Как зарегистрировать два аккаунта Вк
Создать функционирующие профили можно несколькими способами.
На один номер
Работоспособность таких учетных записей зависит от того, правильно ли выполнена привязка контакта. Что нужно сделать:
- Зайти на главную страницу соцсети и кликнуть «Зарегистрироваться».
- Ввести номер, который далее будет привязан к двум страницам. Кликнуть «Продолжить».
- По запросу системы подтвердить данные любым из доступных способов и нажать «Продолжить».

- Заполнить профиль. Прикрепить фото и информацию о себе.
- Создать вторую учетную запись. Далее действия выполнять в ней.
- Нажать на фото профиля в правом верхнем углу страницы. В выпадающем меню кликнуть на свой профиль еще раз (подсвечивается светло-серым цветом).
- Кликнуть на меню «Безопасность и вход».
- Выбрать вкладку «Номер телефона».
- Ввести контакт, привязанный к первой учетной записи. Нажать «Получить код».
- Система выдаст предупреждение о доступном количестве привязок. Принять.
- Подтвердить операцию любым способом. Заявка отправится на рассмотрение.
- Если профиль нужен сейчас, нажать «Ускорьте процесс».
- Кликнуть «Продолжить».
- Кликнуть «Продолжить» еще раз.
- Ввести код, отправленный системой на зарегистрированный номер аккаунта. Нажать «Отправить».
После выполненной привязки вход на обе страницы доступен по одному мобильному контакту. Об этом появится уведомление в первом аккаунте.
Об этом появится уведомление в первом аккаунте.
С помощью виртуального номера
Виртуальный номер надежно защищает пользовательские данные при создании учетной записи. После регистрации от арендованного контакта можно мгновенно отказаться.
Для создания профиля таким способом необходимо:
- Выбрать сервис виртуальных номеров, например SMS ACTIVATE.
- Зарегистрироваться в приложении.
- На указанную электронную почту придет письмо подтверждения. Нажать «Подтвердить».
- Найти вкладку для пополнения баланса.
- Выбрать предпочтительный способ пополнения счета.
- Пополнить баланс.
- Выбрать сервис ВК, указать страну. Кликнуть на «Активации» или «Аренда».
- Сервис на указанное время предоставит в пользование виртуальный номер.
- Ввести данный контакт при регистрации аккаунта ВК. Нажать «Продолжить».
- В сервис SMS ACTIVATE придет смс с кодом. Полученное сообщение ввести в ВК.
 Кликнуть «Продолжить».
Кликнуть «Продолжить». - Создать и заполнить аккаунт. Привязать контакт с первого профиля, как в предыдущем пункте.
ВАЖНО! При однократном использовании виртуального номера, если к странице не привязан контакт из первого аккаунта, восстановление доступа к нему будет возможно только через техподдержку соцсети. Также важно знать, что арендованные данные уже могли использоваться при создании учетной записи в соцсети ВК. Если регистраций по ним выполнено много, система выдаст отказ.
Без номера
С 2012 года новым пользователям больше не доступна регистрация страницы ВК через электронную почту без указания мобильного контакта. Причиной стало появление большого количества спам-аккаунтов и мошеннических сайтов.
Переключение между профилями
При наличии двух и более учетных записей ВК целесообразно настроить быстрый переход между ними.
На компьютере
Рекомендуется установить специальное расширение, которое позволит быстро переключаться между страницами, не выполняя вход на каждую. Рассмотрим на примере расширения VK+Switcher. Для установки приложения необходимо:
Рассмотрим на примере расширения VK+Switcher. Для установки приложения необходимо:
- В любом магазине расширений браузера найти программу и нажать «Установить». Система запросит разрешение на установку. Кликнуть «Установить расширение».
- Открыть первую учетную запись «Вконтакте». На верхней панели инструментов нажать на иконку «VK+Switcher». Кликнуть на вкладку «Новый профиль». Ввести название. Нажать на клавиатуре «Enter».
- Зайти во второй профиль. Выполнить те же действия.
- Повторить пропорционально количеству созданных аккаунтов ВК.
- Для переключения между страницами на открытой вкладке ВК нажать на «VK+Switcher» и кликнуть на значок «Лист». Обновить открытую страницу.
В приложениях IOS и Android
Переход между профилями в мобильной версии ВК настраивается двумя основными способами.
Через меню ВК
Как настроить:
- Авторизоваться в первом профиле.
- Нажать на меню «Три полосы».
- Выбрать «Выйти» в нижней части страницы.

- Войти во второй и во все последующие аккаунты, выполнить те же действия.
- На экране отобразятся все аккаунты пользователя. Переключение между ними происходит простым нажатием на любой профиль.
С помощью программы «Ночной ВК»
Переход настраивается следующим образом:
- Зайти в Google Play» и скачать приложение «Ночной ВК».
- Открыть приложение и кликнуть «Войти в ВК».
- В левом верхнем углу нажать на меню «Три черты».
- В открывшемся меню кликнуть на значок «Крестик» (добавить).
- Выполнить действия пунктов 3-5 для всех аккаунтов.
- При входе в «Ночной ВК» переключение между всеми созданными учетными записями доступно в боковом меню.
Видео-обзор
Предлагаем вашему вниманию видео-обзор о том, как добавить вторую учетную запись в соцсети «Вконтакте».
com/embed/gidG6Rz1S3o» allowfullscreen=»allowfullscreen»>Рекомендации по фарму аккаунтов через антидетект браузер — Dolphin Team на vc.ru
1041 просмотров
Антидетект браузер Dolphin{Anty} подходит для разных целей: фарм аккаунтов, арбитраж трафика, беттинга, работы с криптовалютой и т.д. В этом материале мы собрали некоторые рекомендации по фарму аккаунтов, которыми делились пользователи нашего браузера.
Если вы только начинаете фармить аккаунты или вам нужно небольшое количество аккаунтов для личных целей, этот материал поможет вам избежать банальных ошибок в процессе создания аккаунтов. Для профессиональных фармеров в этой статье ничего нового нет, поэтому вы просто можете бесплатно протестировать антидетект браузер Dolphin{anty} 🤩
Что такое фарм аккаунтов
Фарм или фарминг аккаунтов — это процесс создания и подготовки аккаунтов для работы с различными сайтами и соцсетями. В процесс фарма входит:
- Предварительная подготовка устройства и ПО к фарму;
- Подготовка данных для настройки аккаунта;
- Создание аккаунта;
- Прогрев аккаунта — создание активностей, чтобы защитные системы сайта успели проанализировать поведение пользователя.

Фармеры — это люди, которые профессионально занимаются созданием и настройкой аккаунтов. Фармеры могут работать на себя, на компанию, которая занимается продажей аккаунтов, или внутри команды, которой часто нужны аккаунты.
Зачем использовать антидетект браузер для фарма аккаунтов
Для создания и подготовки аккаунтов почти ни один пользователь не обходится без антидетект браузера — программы, которая меняет реальный цифровой отпечаток.
На это есть несколько причин:
⛔ Причина 1: Ограничение по количеству аккаунтов
В разных соцсетях и сервисах есть ограничения по количеству аккаунтов, которые может создать один пользователь. Например, в Instagram к одному номеру можно привязать до 5 аккаунтов, на криптовалютной бирже Binance — не более 1. При этом, если пользователь попытается создать с одного устройства сразу несколько аккаунтов, без помощи антидетект браузера система вряд ли даст это сделать.
Дело в том, что антифрод-системы сайтов анализируют не только указанные пользователем данные, но и информацию о его устройстве, местоположении, браузере — цифровой отпечаток.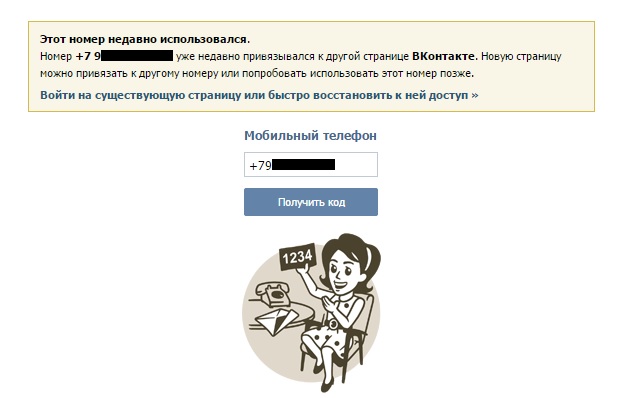
С помощью антидетект браузера и прокси, можно изменить данные отпечатка и создавать сколько угодно профилей с одного устройства.
🌍 Причина 2: работа с зарубежными аккаунтами
С помощью антидетект браузера и прокси можно выдавать себя за пользователей других стран. Это нужно для:
- создания и последующей продажи зарубежных аккаунтов. Все страны делятся на три группы в зависимости от платёжеспособности населения: Tier-1, Tier-2 и Tier-3. Tier-1 — это страны с самым платежеспособным населением, к которым относятся США, Канада, Великобритания, Франция, Италия, Германия, Австралия и т.д. Поскольку в этих странах можно получить наибольший заработок, аккаунты этих стран пользуются высоким спросом,
- работы с зарубежными сайтами. Это может быть особенно актуально сейчас, когда пользователи некоторых стран, включая Россию и Беларусь сталкиваются с ограничениями в работе.

✅ Причина 3: обход блокировок
Если ранее с конкретного устройства был создан аккаунт, который заблокировали, система может не дать повторно создать с него аккаунт. С помощью антидетект браузера можно будет сделать новый фингерпринт, чтобы обойти эти ограничения.
💰 Причина 4: экономия средств
Без антидетект браузер, для каждого аккаунта пришлось бы подбирать новое устройство. Если нужно всего 2-3 аккаунта, их действительно можно создать с телефона, ноутбука или устройства родственников. Если больше, то антидетект браузер обойдётся дешевле, чем покупка ноутбука и телефона для каждого аккаунта.
Что нужно делать перед созданием аккаунтов
🔹 Выбрать прокси
Хотя в сети можно найти много вариантов бесплатных прокси, мы не рекомендуем их использовать. Дело в том, что IP-адреса таких прокси:
- скорее всего заблокированы на большинстве популярных сайтов,
- небезопасны, ведь непонятно, на чем зарабатывает сервис.

Если ранее вы не работали с прокси, из нашего материала вы узнаете, как выбрать прокси для антидетект браузера или почитайте рекомендации пользователей в нашем официальном телеграм-чате.
🔹 Выбрать антидетект браузер
Сейчас на рынке есть свыше 30 антидетект браузеров. Все топовые программы справляются с задачей маскировки реальных цифровых отпечатков и предлагают пользователям много дополнительных функций, чтобы повысить качество работы. При этом, поскольку антидетект браузеры — дорогое ПО, перед покупкой обязательно воспользуйтесь пробным периодом, чтобы понять, насколько вам подходит конкретный браузер. В частности, качество подмен отпечатков можно проверить с помощью специальных сканеров.
Если вы ещё никогда не пользовались антидетект браузером, в нашей подборке вы сможете ознакомиться с топовыми платными и бесплатными антидетект браузерами.
🔹 Очистить и сформировать новую историю браузера
Чистка куки нужна, чтобы при создании аккаунта в вашей истории не оказалось ссылок на другие аккаунты или сайты с содержанием, которое может насторожить антифрод-системы сайта.
Новая же история нужна, чтобы всё те же алгоритмы могли увидеть ваши куки и предварительно оценить вас. В процессе формирования истории лучше посещать нейтральные сайты, например, новостные издания, маркетплейсы и т.д.
Если вы будете создавать и работать с аккаунтами через Dolphin{anty}, по ссылке вы найдёте подробную инструкцию, как за 5 минут настроить браузерный профиль.
🔹 Подготовить данные для регистрации
Как правило, на сайтах есть несколько способов регистрации новых аккаунтов: по email, номеру телефону или с помощью существующих учетных записей на других сайтах.
Если нужно создавать много аккаунтов, можно использовать виртуальные номера. В таком случае за символическую плату вы сможете воспользоваться номером, чтобы получить код при создании аккаунта. У таких номеров один недостаток: в случае блокировки аккаунта, вы не сможете восстановить его по номеру телефону. По этой причине по возможности пользователи стараются регистрировать аккаунты на адреса почты или же после создания аккаунта, удаляют номер, чтобы получать проверочные коды на почту.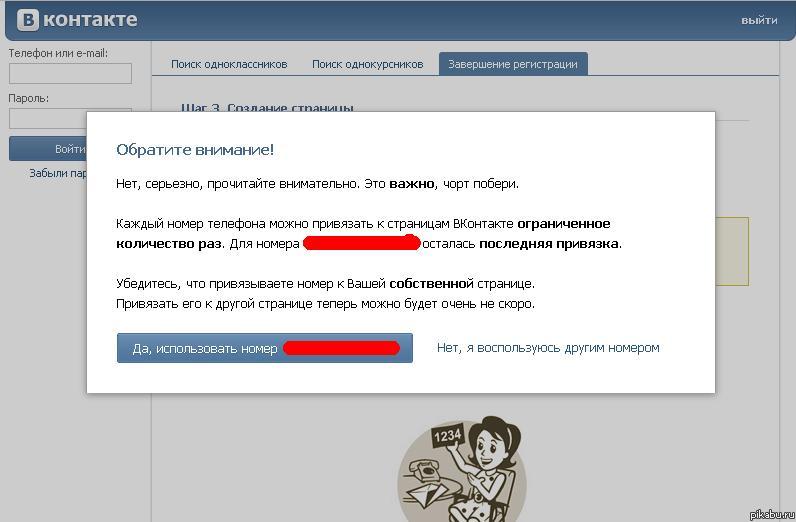
Важно помнить, что данные в каждом аккаунте должны быть уникальными.
🔹 Придумать внутреннюю информацию о пользователе
Почти на всех сайтах обязательными для заполнения являются Ф.И.О., возраст, контакты и местонахождения. Дополнительно могут потребоваться паспортные данные, если речь о букмекерских конторах или криптовалютных биржах.
Чтобы информация не повторялась, данные всех аккаунтов можно записывать в таблице. Хотя некоторые пользователи опровергают необходимость подробного заполнения профилей, мы рекомендуем максимально заполнить профиль.
Некоторые фармеры рекомендуют создавать именно женские аккаунты: таким аккаунтам легче привлечь внимание и набрать френдлист.
🔹 Платежное средство
Если вы создаёте аккаунт для себя и вам предстоит оплачивать услуги на сайте, подумайте о запасных способах оплаты: банковских картах или электронных кошельках.
Как и в случае с другими данными пользователя, если у каких-то аккаунтов будет привязана одинаковая карта или кошелёк, эти аккаунты будут автоматически связаны между собой. На различных форумах описана масса случаев, когда совпадения данных привели к блокировке всей цепочки аккаунтов.
На различных форумах описана масса случаев, когда совпадения данных привели к блокировке всей цепочки аккаунтов.
Что делать во время регистрации аккаунта
Процесс регистрации будет зависеть от того, в каком именно сервисе или соцсети вы регистрируетесь.Для соцсетей важно не только заполнить информацию для регистрации, но и добавить фото. Если вы будете использовать фото из интернета, их важно уникализировать: отредактировать оформление фото и изменить метаданные. Для изменения метаданных есть специальные программы, например Exif Pilot, Metadata++ или AnalogExif.
Что делать после регистрации аккаунта
В сети есть много споров на тему того, нужен ли вообще прогрев аккаунтов или это всё лишнее устрашение пользователей. Учитывая, как внимательно антифрод-системы анализируют данные пользователей, вплоть до того, как человек передвигает мышку по экрану, мы считаем, что прогрев необходим.
Прогрев подразумевает, что после создания аккаунта вы сначала будете имитировать действия обычного пользователя: просмотрите разные вкладки сайта, почитаете статьи о сервисе и т. д.. Если речь о соцсетях, можно листать новостную ленту, ставить реакции на посты, переписываться с другими пользователями и т.д.
д.. Если речь о соцсетях, можно листать новостную ленту, ставить реакции на посты, переписываться с другими пользователями и т.д.
Чтобы быстрее набрать френдлист, можно оставлять комментарии под различными постами, чтобы привлечь внимание других пользователей. При этом, лучше не рассылать заявки в друзья, если это неизвестные вам пользователи: другие пользователи могут пожаловаться на спам, и аккаунт отправят на проверку.
Важно, что помимо основных шагов, таких как подготовка ПО, данных и сама регистрация, нет никакого универсального и правильного способа подготовка аккаунтов. У каждого фармера есть свои стратегии и схемы, которые они разрабатывают в процессе работы. Ключевое, что нужно помнить — вообще поведение должно максимально походить на обычного пользователя.
Если у вас есть свои рекомендации по фарму аккаунтов, можете делиться ими в нашем телеграм-чате или в комментариях к этой статье. 😉
Как создать вторую страницу в ВК без номера телефона? Создаем второй аккаунт Вконтакте
Сегодня мы с вами рассмотрим подробнее тему о том, как создать второй аккаунт в вк, можно ли иметь сразу несколько аккаунтов в вк, а также узнаем, как на один номер зарегистрировать две страницы вконтакте.
На сегодняшний день, в соцсети Вконтакте внедрили обязательную процедуру регистрации с указанием мобильного номера телефона. Обязательным фактором является то, что для одного профиля можно привязать только один номер телефона.
Пользователи регистрируются Вконтакте не только для личного общения, обмена информации, но и для работы. Например, это может быть, как продвижение своего бренда, оказание консультаций в разных сферах деятельность (продажи, фитнес-индустрия и т.д.), так и digital-сфера (арбитраж трафика, СММ).
Поэтому, в связи с данным вопросом, возникает большое количество запросов от пользователей в поисковых сервисах. Сегодня мы рассмотрим один из них.
Содержание
- Зачем нужна вторая страница?
- Как сделать две страницы ВКонтакте, к которым привязан один номер телефона
- Процесс регистрации нового аккаунта в вк
- Как создать новую страницу с виртуальным номером
- Как сделать вторую страницу в Вк если есть второй номер
- Как создать 2 аккаунт в ВК через фейсбук и анонимайзер
- Видео гид.
 Как создать второй профиль Вконтакте
Как создать второй профиль Вконтакте
Зачем нужна вторая страница?
Как мы уже упоминали ранее, пользователи могут регистрировать второй аккаунт непосредственно для заработка в социальной сети.
Один из видов небольшого заработка связан с увеличением лайков, репостов, комментариев и прочего повышения активности, как у себя, так и у других пользователей через сервисы по накрутке. Если вы решили заняться этим, то мы рекомендуем как раз работать с вашего второго, не основного профиля, так как он может быть послан в теневой бан временно или же вовсе быть заблокирован администрацией за спам и чрезмерную активность.
Привязывайте резервный аккаунт, который недавно создали к таким сайтам, чтобы в случае взлома или утечки вашей цифровой информации (личные переписки, фотографии, пароли или деньги на VK PAY). Также, с вашей страницы могут рассылаться сообщения всему списку друзей с просьбой срочно скинуть деньги на карту и т. д.
д.
Во избежание таких ситуаций, советуем вам перечитать основные правила Вконтакте.
Это касается непроверенных сервисов, которые могут обещать вам высокий доход по сравнению с другими сайтами, которые работают долго и являются надежными. Читайте отзывы о подобных веб-страницах и принимайте правильное решение.
Как сделать две страницы ВКонтакте, к которым привязан один номер телефона
Вопрос о том, как создать еще одну страницу в контакте с привязкой к одному номеру один из наиболее актуальных. Но, к сожалению, сразу разочаруем – этого сделать не получится. Если мобильный номер уже привязан к первой странице в социальной сети, то вторую вы никак не сможете подключить. Ни одна программа и проложение не поможет.
Тем более, это небезопасно и может грозить блокировкой обеих страниц в виду множества подозрительных действий со сменой номеров.
Процесс регистрации нового аккаунта в вк
Как создать новую страницу с виртуальным номером
Рассмотрим один из популярных сервисов по покупке виртуальных номеров для подтверждения регистрации в социальных сетях или иных доступных сервисах.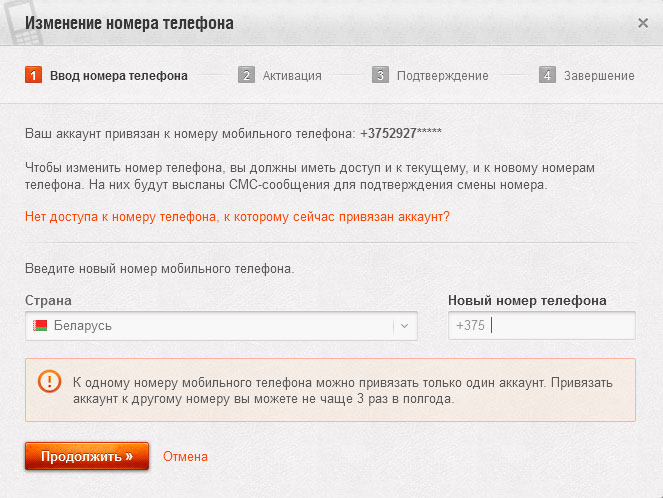
sms-activate
Выполняем пошагово:
- Переходим по ссылке в сервис.
- Кликаем по кнопке «Войти/Регистрация« проходим регистрацию
- Проходим регистрацию и входим в личный кабинет. заполняем все поля
- Пополняем баланс счета, чтобы совершить покупки. пополняем баланс
- С левой стороны страницы, в поиске пишем название соцсети «Вконтакте» и выбираем страну с мобильным оператором. Указываем количество и покупаем номер. покупаем номер
- Далее, копируем номер, который приобрели и вставляем его в поле регистрации Вконтакте. После успешного ввода, дождитесь, когда смс-код придет в раздел, где указан ваш виртуальный номер.
Рассмотрим подробнее один из методов авторизации нового профиля в соцсети. Выполняем пошагово:
- Переходим на главную страницу Вконтакте.
- Перед нами будет форма входа. Нажимаем кнопку «Регистрация«.
 кликаем на кнопку
кликаем на кнопку - Итак, вы получили виртуальный номер. Вводим его в строку с номером телефона. Ждем смс-код, который придет в сервис с сим-картами. Копируем код и вставляем в графу с подтверждением вк. вводим номер и подтверждаем код
- Придумываем сложный пароль, чтобы повысить безопасность профиля от взлома.
- После успешного окончания, можете приступать к настойке и редактированию информации о себе.
Как сделать вторую страницу в Вк если есть второй номер
Во-первых, чтобы постоянно не выходить с основной страницы в соцсети и входить в другую, вы можете использовать несколько браузеров. Наиболее комфортными являются Google Chrome и Firefox. Мы также используем их в повседневной связке, когда необходимо работать с одним сервисом без выхода с основного аккаунта.
Расположите ярлыки рядом на вашем рабочем столе для быстрого доступа.
расположите ярлыки рядомТеперь перейдем к самому вопросу. Способ практически ничем не разнится от основного.
Выполняем пошагово:
- Запускаем второй браузер. Вводим адрес сайта.
- Попадаем на главную страницу. Можете войти в основной профиль. главная страница
- Далее, переходим в раздел «Друзья» через главную панель слева. переходим в раздел
- В новом окне выбираем строку «Поиск друзей«. переходим
- Справа, в разделе поиска, пролистайте вниз и увидите кнопку «Пригласить друзей«. Жмем. жмем на кнопку
- Откроется новое окно с формой приглашения друзей.
- Вводим имя и фамилию, а также указываем номер мобильного телефона.
- Кликаем на кнопку «Отправить приглашение» и закрываем окно. выполняем пошагово
- Аккаунт, который будет создан по пригласительной ссылке еще предстоит авторизовать полностью.
 Самостоятельно закончите процесс регистрации.
Самостоятельно закончите процесс регистрации. - Кликните на ссылку с подписью «Добавить в друзья«. По итогу, наступит завершающий процесс создания профиля.
- Указываем еще один номер мобильного телефона, дожидаемся код и подтверждаем данные. подтверждаем код
- Создаем сложный пароль для безопасности.
- Готово.
Обратите внимание, что для вас доступна функция для приглашения друзей в количестве до 18 человек. После заполнения информации, письмо со ссылкой будет отправлено либо на мобильный телефон, либо на эмейл.
Как создать 2 аккаунт в ВК через фейсбук и анонимайзер
Социальная сеть дает возможность авторизовываться через профиль Facebook (запрещенная организация в РФ). Вы можете это сделать через сервис-анонимайзер. Например, рассмотрим такой как Хамелеон.
Выполняем пошагово:
- Видим окно регистрации «Впервые ВКонтакте». Кликаем на кнопку с Facebook;
- Жмем «Продолжить как..(ваше имя)» . Если ваша учетная запись и пароль сохранились в браузере, то вход будет произведен автоматически.
- Далее, увидите новое окно, в котором нужно будет подтвердить эмейл и ваше имя.
 подтверждаем данные
подтверждаем данные - Готово.
Видео гид. Как создать второй профиль Вконтакте
Как привязать, изменить или отвязать телефон
Благодаря привязке к мобильному телефону вы всегда сможете восстановить доступ к аккаунту. Если мошенники узнают ваш пароль, вы сможете просто изменить его, запросив код подтверждения на номер своего мобильного телефона, и сохранить учётную запись в безопасности.
Привязка игрового аккаунта к мобильному телефону — бесплатная операция.
При привязке учётной записи к мобильному телефону ваш номер будет использоваться только для отправки вам SMS с кодами. Никаких рассылок на указанный номер отправляться не будет.
Как привязать телефон
- Авторизуйтесь и перейдите в Личный кабинет. На странице Личного кабинета, в настройках безопасности аккаунта, нажмите кнопку «Привязать».
- На электронную почту, которую вы используете для входа в игру, будет отправлено письмо со ссылкой активации.
- Проверьте свой почтовый ящик и перейдите по ссылке, чтобы активировать привязку.

Что делать, если нет доступа к почте?
Что делать, если письмо не приходит?
- Введите адрес электронной почты и пароль, которые вы используете для входа в игру, чтобы подтвердить привязку.
- Укажите свою страну проживания и номер мобильного телефона, а затем нажмите Продолжить.
- Проверьте правильность введённых данных и нажмите на кнопку Получить СМС-код.
- На указанный вами номер телефона придёт SMS с кодом подтверждения. Введите полученный код в специальное поле и нажмите Активировать.
Что делать, если код не пришёл?Вы можете запросить код ещё раз, но только два раза в сутки и не ранее, чем через 15 минут после предыдущего запроса.
- Если привязка прошла успешно, вы увидите соответствующее сообщение. После этого нажмите Закрыть.
- Информация о привязке телефона также будет обновлена в Личном кабинете.
Как изменить телефон
Если вы привязали учётную запись к номеру телефона, то всегда можете его изменить. Однако если вы не привязывали учётную запись к своему номеру телефона и доступ к ней получил злоумышленник, то он может совершить привязку раньше вас. Что делать, если аккаунт взломали и нет доступа к учётной записи?
Однако если вы не привязывали учётную запись к своему номеру телефона и доступ к ней получил злоумышленник, то он может совершить привязку раньше вас. Что делать, если аккаунт взломали и нет доступа к учётной записи?
Мы настоятельно рекомендуем привязывать аккаунт к номеру телефона, чтобы в случае потери контроля над учётной записью вы смогли самостоятельно восстановить доступ к ней.
Изменить номер телефона можно не раньше, чем через месяц после привязки, и не чаще, чем трижды за полгода. Если у вас нет доступа к своему номеру мобильного телефона, отправьте запрос оператору мобильной связи для восстановления номера.
- Авторизуйтесь и перейдите в Личный кабинет. На странице Личного кабинета, в настройках безопасности аккаунта, нажмите на слово «Настройки» справа от текущего телефонного номера. Затем нажмите кнопку «Изменить».
- Выберите свою страну, введите новый номер телефона и нажмите Продолжить.
- Проверьте правильность введённых данных и нажмите на кнопку Получить СМС-код.

- На новый номер придёт SMS с кодом активации. Введите полученный код в соответствующее поле и нажмите Активировать.
Что делать, если код не пришёл? - На номер, к которому привязан аккаунт в данный момент, придёт код подтверждения. Введите полученный код в соответствующее поле и нажмите Подтвердить.
Что делать, если код не приходит? - Отобразится сообщение о том, что номер успешно изменён. Завершите изменение номера, нажав ОK.
- Информация также будет обновлена в Личном кабинете.
Как отвязать телефон (доступ к номеру есть)
Если вы привязали аккаунт к номеру телефона, то всегда можете удалить привязку.
Однако, если вы не привязывали учётную запись к своему номеру телефона и доступ к ней получил злоумышленник, то он может совершить привязку раньше вас.
Что делать, если аккаунт взломали и нет доступа к учётной записи?
Мы настоятельно рекомендуем привязывать аккаунт к номеру телефона, чтобы в случае потери контроля над учётной записью вы смогли самостоятельно восстановить доступ к ней.
- Авторизуйтесь на официальном портале любой из наших игр или на сайте Wargaming.net и перейдите в Личный кабинет.
- На странице Личного кабинета, в настройках безопасности аккаунта, нажмите слово «Настройки» справа от текущего телефонного номера, а затем на ссылку «Удалить привязку».
- Чтобы подтвердить своё желание удалить привязку, нажмите Продолжить.
- На номер, к которому привязан аккаунт, придёт SMS с кодом активации. Введите полученный код в соответствующее поле и нажмите Удалить.
Что делать, если код не пришёл? - Отобразится сообщение о том, что удаление привязки прошло успешно. Завершите удаление привязки, нажав ОK.
- Если вы удалили привязку, то совершить её заново можно не раньше, чем через месяц после предыдущей привязки и не чаще трёх раз в полгода. Если у вас нет доступа к своему номеру телефона, отправьте запрос оператору мобильной связи для восстановления номера.

Как отвязать телефон (доступа к номеру нет)
Если вы привязали аккаунт к номеру телефона, то всегда можете удалить привязку. Но если аккаунт не привязан к телефону и доступ к нему получил злоумышленник, то он может совершить привязку раньше вас. Что делать, если аккаунт взломали и нет доступа к учётной записи?
- Войдите в Личный кабинет с помощью электронной почты и пароля. В настройках безопасности аккаунта, нажмите слово «Настройки» справа от текущего телефонного номера, а затем на ссылку «Удалить привязку».
- Чтобы подтвердить удаление, нажмите на ссылку «Нет доступа к телефону».
- Введите номер телефона, к которому привязан аккаунт, и нажмите Продолжить.
- Чтобы подтвердить удаление привязки, перейдите по ссылке из письма, которое придёт на вашу почту. Ссылка действительна 24 часа.
- В Личном кабинете отобразится сообщение, что ваш запрос принят. В нём вы также найдёте дату, когда привязка будет удалена, и ссылку для отмены удаления.

- Вам также придёт уведомление на сайте и в клиенте игры. Такие уведомления будут приходить вам раз в неделю, пока привязка не будет удалена.
Отмена удаления привязки
- Войдите в Личный кабинет с помощью электронной почты и пароля. Нажмите на ссылку «Отменить операцию» в инфоокне сверху.
- Укажите причину отмены и нажмите Отменить отвязку. Готово!
Cколько аккаунтов в world of tanks можно привязать к одному номеру телефона?
- Автор темы Ferstikpnz
- Дата начала
Ferstikpnz
Ferstikpnz
- #1
Cколько аккаунтов в world of tanks можно привязать к одному номеру телефона?
Сортировка по дате Сортировка по голосам
aidar911
aidar911
- #2
Один видно, а какой смысл тогда было к привязке к телефону? У них изначально привязки и не было. .. но видно стали уж много делать акк.
.. но видно стали уж много делать акк.
Позитивный голос 0
Николай58
Николай58
- #3
Позитивный голос 0
ALEX6545
ALEX6545
- #4
aidar911 написал(а):
Один видно, а какой смысл тогда было к привязке к телефону? У них изначально привязки и не было.
.. но видно стали уж много делать акк.
Нажмите для раскрытия…
Вы серьёзно?etrosyan:
Много АКК создаётся , говорите? А что без привязки к телефону нельзя АКК создать?
Позитивный голос 0
Катя8
Катя8
- #5
1 акк, почту вроде 5 акков
Позитивный голос 0
Войдите или зарегистрируйтесь для ответа.
Вопрос Minecraft vs World of Tanks
- Player72
- Общение Python мододелов
- Ответы
- 7
- Просмотры
- 874
Djonny_modPack
Вопрос Решает ли донат в World Of Tanks?
- Миша это я
- Общение Python мододелов
- Ответы
- 15
- Просмотры
- 1K
xx1xxzzzzzzsw
Вопрос Почему World Of Tanks многие сейчас хейтят?
- женя аноним
- Общение Python мододелов
- Ответы
- 7
- Просмотры
- 853
ivantutaev
Вопрос Стоит ли начинать играть в World Of Tanks?
- ImGaMeR
- Общение Python мододелов
- Ответы
- 14
- Просмотры
- 1K
Kleshnia
Вопрос Что лучше World of Tanks или корсары Каждому своё
- ruslik
- Общение Python мододелов
- Ответы
- 6
- Просмотры
- 542
dragan
Поделиться:
Vkontakte Odnoklassniki Mail. ru Liveinternet Livejournal Facebook Twitter Reddit Pinterest Tumblr WhatsApp Telegram Viber Skype Line Gmail yahoomail Электронная почта Поделиться Ссылка
ru Liveinternet Livejournal Facebook Twitter Reddit Pinterest Tumblr WhatsApp Telegram Viber Skype Line Gmail yahoomail Электронная почта Поделиться Ссылка
Как узнать аккаунты, привязанные к номеру телефона
Гугл-аккаунт – это огромная сеть дополнительных возможностей, которые появляются у обладателя профиля. Он связывает многие полезные сервисы от компании, а также дает пользователю возможность скачивать игры с Плей маркета. Если пользователь является обладателем телефона на системе андроид, то у него с огромной вероятностью имеется свой гугл-профиль, иначе он бы не смог скачивать игры, программки и другие утилиты на свое устройство.
Содержание
- Как узнать, есть ли у вас гугл-аккаунт
- Как посмотреть свой аккаунт в телефоне
- Как узнать аккаунты, привязанные к номеру телефона
- Как привязать аккаунт Гугл к номеру телефона
Как узнать, есть ли у вас гугл-аккаунт
Гугл- профиль объединяет в себе многие другие утилиты, такие как:
- Ютуб;
- Gmail;
- Карты;
- Облако;
- И многие другие.

Чтобы облегчить жизнь пользователям, был создан один общий аккаунт, с помощью которого можно использовать все возможности одной большой системы. Она отлично работает вместе, так как общий аккаунт – ключ ко всем другим. Преимущество также заключается в том, что пользователю не нужно будто постоянно запоминать отличные друг от друга пароли, ведь имеется один общий для всех.
Если пользователь забыл, есть ли у него аккаунт или нет, то он может воспользоваться официальным сайтом от системы. Войдя в плей маркет, например, или же на почту, пользователь увидит специальное окно, в котором стоит ввести тот электронный адрес, который запомнил ранее. Если система выдает, что такого аккаунта не существует, то значит, что пользователю стоит зарегистрироваться. Более подробно о процессе регистрации и заведение аккаунта стоит посмотреть в этом видео
https://www.youtube.com/watch?v=oFgCGIMjJEA
Пользователь мог забыть, что потерял свой аккаунт, когда перешел на другую систему, например, на телефоны от компании Эппл. У iOS отличная от Андроида система. В ней имеется собственный аккаунт с настройками.
У iOS отличная от Андроида система. В ней имеется собственный аккаунт с настройками.
Если пользователь узнал, что у него есть свой аккаунт, то он может восстановить доступ к нему. Если система попросила пользователя после ввода адреса электронной почты ввести и пароль от неё, то это значит, что аккаунт есть и человек может получить к нему доступ обратно.
Как посмотреть свой аккаунт в телефоне
На телефоне Андроид можно посмотреть свой аккаунт. Так как Гугл-профиль – важная система, с помощью которой в значительной роли функционирует сам телефон, то вся информация должна присутствовать в системе телефона. Так оно и есть. Информация обо всех профилях, которые имеются в активном доступе на телефоне, доступна в настройках.
Чтобы более подробно посмотреть, есть ли аккаунт на телефоне, стоит сделать несколько шагов:
- Для начала необходимо разблокировать устройство при помощи ввода пин-кода или же другим способом;
- После стоит открыть тот экран, на котором располагаются настройки.
 Сами по себе настройки выглядят как шестеренка на сером фоне. Под ними написано «настройки».
Сами по себе настройки выглядят как шестеренка на сером фоне. Под ними написано «настройки». - Необходимо тапнуть на эту иконку, чтобы в дальнейшем перейти в настройки;
- Листаем и находим такой пункт, как «аккаунты». Переходим на него кликом;
- Теперь пользователь может посмотреть свой аккаунт. Если в списке есть строчка «Google», то это именно тот профиль, который необходим;
- Кликнув на сам аккаунт, пользователь может взять и скопировать свой адрес электронной почты. К сожалению, пароль пользователь должен знать сам, а не при помощи системы.
Таким образом пользователь может убедиться, есть ли на его устройстве гугл – профиль, а также узнать его подробнее. Если пользователь хочет снова получить доступ к нему, но не помнит пароля, то он может посмотреть это видео и восстановить доступ к системе
Как узнать аккаунты, привязанные к номеру телефона
Если обладатель Гугл- профиля хочет узнать, какие номера телефона синхронизированы с его страничкой, то он может это сделать через неё. Он должен понимать, что посмотреть номера, которые привязаны к системе, просто невозможно, потому что номер всегда один.
Он должен понимать, что посмотреть номера, которые привязаны к системе, просто невозможно, потому что номер всегда один.
Можно посмотреть те устройства, которые доступны для подключения к системе. Для того, чтобы сделать это, необходимо провести следующий алгоритм:
- Для начала необходимо войти в свой гугл аккаунт через специальный сайт. Делается это также при помощи указания электронной почты и пароля от неё; Обратите внимание! Для этого способа также необходимо знать свой адрес электронной почты и пароль для неё, чтобы в дальнейшем войти в систему.
- Теперь необходимо в личном кабинете найти такой пункт, как «Безопасность». Он располагается на левой панели, которая автоматически открывается на компьютерной версии. На телефонном браузере такое меню открывается на той же стороне, только при помощи клика на три полоски в левом верхнем углу;
- После этого пользователь видит все те устройства, на которых использовался аккаунт;
- Если пользователь хочет в подробностях узнать о том или ином устройстве, то он может кликнуть на пункт под названием «Управление устройствами»;
- В нем автоматически покажутся все андроид устройства.
 Если кликнуть на такую же кнопку, то в подробностях можно узнать обо всех характеристиках.
Если кликнуть на такую же кнопку, то в подробностях можно узнать обо всех характеристиках.
Таким образом пользователь может узнать о тех устройствах, к которым привязан профиль.
Как привязать аккаунт Гугл к номеру телефона
Если пользователю необходимо в дальнейшем сделать так, чтобы привязать новый номер телефона к своему аккаунту, то он может воспользоваться системой, а также теми возможностями, которые доступны.
Стоит отметить, что подключение номера телефона должно было проходить еще на первых этапах, когда пользователь первый раз заходил, регистрировался и указывал свой рабочий номер телефона. Если же он поменялся, то необходимо сделать следующее:
- Для начала необходимо зайти в свой аккаунт гугл через любой из браузеров на телефоне. Входим при помощи того адреса электронной почты и пароля, который известен пользователю;
- Теперь же необходимо кликнуть на панель в левом верхнем углу и открыть настройки конфиденциальности;
- Кликаем на второй пункт под названием «Помогите связаться с вами», который спрашивает о нахождении пользователя в других сервисах гугл по номеру телефона;
- Опускаем глаза и видим тот номер телефона, который пользователю необходимо сменить;
- Кликаем на пункт «Изменить номера», которые позволяют пользователю в дальнейшем не только входит в профиль, но и поддерживать контакт с другими пользователями;
- После этого меняем телефон, соглашаемся с системой.

Таким образом пользователь смог привязать совершенно другой номер телефона к аккаунту от Гугл.
Обратите внимание! Для этого способа необходимо иметь доступ к электронной почте, а также и к самому аккаунту. Это необходимо, чтобы в дальнейшем изменить данные. Без этого пункта изменение невозможно.
Вячеслав
Несколько лет работал в салонах сотовой связи двух крупных операторов. Хорошо разбираюсь в тарифах и вижу все подводные камни. Люблю гаджеты, особенно на Android.
Задать вопрос
Почему может быть привязан только один номер телефона?
Если к одному аккаунту будет привязано несколько мобильных номеров телефона, то система автоматически сломается. Все восстановление профиля происходит как раз через номер телефона, а если их будет подключено очень много, то пользователь не сможет восстановить свой аккаунт. Это сделано для удобства.
Что делать, если номер телефона поменялся?
Необходимо также поменять и номер телефона, который указан в аккаунте от компании Гугл. Стоит отметить, что сделать это лучше ещё тогда, когда у пользователя имеется доступ к старому, потому что система может потребовать ввести те данные, которые она отправит на старый номер.
Стоит отметить, что сделать это лучше ещё тогда, когда у пользователя имеется доступ к старому, потому что система может потребовать ввести те данные, которые она отправит на старый номер.
Можно ли обойтись без номера телефона, привязанного к аккаунту?
Нет, такого не может быть. Конечно, осуществляют специальные способы обхода регистрации без помощи номера телефона, но они достаточно опасны, поэтому не стоит пользоваться ими. Номер телефона – это обязательный атрибут, который сделан прежде всего для удобства пользователя, а не системы. В дальнейшем с помощью его пользователь сможет восстановить аккаунт.
Как зарегистрироваться в ВК без номера телефона
Причин создать аккаунт ВК без номера телефона бесчисленное множество.
Может быть, вам нужна дополнительная учетная запись для бизнеса, личного использования или для того, чтобы
сохранить свою анонимность в социальной сети. Каковы бы ни были ваши причины, в
2023 поисковый запрос «вк без телефона
число» становится все более популярным.
Очевидно, администрация ВКонтакте выступает против, т.к. настолько, насколько они могут, стремясь прекратить анонимность пользователей. Мы можем предложить вам несколько вполне законные способы преодоления этой проблемы.
Можно ли зарегистрироваться в вк без телефона число?
Зайди на главную страницу ВКонтакте и посмотри процедура регистрации. Понятно, что для создания учетной записи или для войти, вам нужно использовать свой номер телефона. Однако не сдавайтесь слишком рано. В 2023 есть еще способы обойти требования администрации и зарегистрировать учетную запись, не раскрывая свой номер телефона. В основном у вас есть два способами:
- ВКонтакте регистрация через ваш Аккаунт Facebook или
- вход через SMS с помощью SMS-сервис «Тигр».
Зарегистрироваться в ВК без номера телефона с помощью виртуального номера
На данный момент это единственный безопасный способ регистрации
в ВК и получить доступ к функционалу платформы. Зарегистрироваться ВК без номера телефона можно с помощью онлайн
платформа для приема СМС.
Зарегистрироваться ВК без номера телефона можно с помощью онлайн
платформа для приема СМС.
Тигр смс это топ решение в этой области, позволяющее пользователям регистрировать независимо от того, сколько учетных записей, без ущерба для анонимности и использования реального номера телефона. Также, разовое получение смс на Tiger СМС меньше хлопотно и дорого, чем получить настоящую SIM-карту. Наша платформа предлагает виртуальные номера для регистрации ВКонтакте от 3 центов.
Ознакомьтесь с нашими предложение для регистрации ВК без номера телефона как а также решения для создания аккаунтов на других популярных ресурсах.
Наша платформа позволяет создавать сколько угодно аккаунты на популярных платформах со всего мира, практически мгновенно и доступно. Кроме того, вам будет доступен виртуальный номер телефона для заполнения. регистрация практически в любой стране. Используйте Tiger SMS и наслаждайтесь анонимностью!
Как зарегистрироваться в ВК без номер телефона с помощью Tiger SMS
1) Создать
учетная запись на платформе Tiger SMS. Для этого нажмите здесь или нажмите кнопку
«Регистрация» в правом верхнем углу этой страницы.
Для этого нажмите здесь или нажмите кнопку
«Регистрация» в правом верхнем углу этой страницы.
2) Введите ваши данные в пару обязательных полей: имя пользователя, электронная почта, пароль. Тогда соглашайтесь к нашим стандартным пользовательским условиям;
3) Проверить ваш адрес электронной почты для письма подтверждения и нажмите кнопку, чтобы подтвердить свой электронная почта.
4) Открытый на странице «Пополнить баланс» и перевести необходимую сумму денег на свой счет. Мы принимаем банковские карты, электронные деньги или криптовалюту;
5) Перейти к на странице «Купить номер телефона». Выберите, какую платформу вы хотите использовать, страну для вашего виртуального номера телефона и оператора мобильной связи. Завершите свой выбор и посмотреть стоимость одноразового SMS с выбранной платформы.
6) Возврат выбрать платформу и подтвердить заказ, нажав кнопку «Купить»;
7) Ваш
номер телефона появится в поле «Активные телефоны» под блоком
выбранной услуги в формате соответствующей страны. Скопируйте это.
Скопируйте это.
8) Открыто на главную страницу ВК и пройти стандартную процедуру регистрации.
9) Войти свои данные в необходимые поля. В поле с номером телефона введите номер, сгенерированный Tiger SMS.
10) платформа отправит вам код подтверждения, который вы сможете увидеть на Tiger SMS рядом с купленным номером. Скопируйте код.
11) Использование этот код, чтобы подтвердить свой номер телефона на странице ВКонтакте и завершить Регистрация. Теперь вы можете использовать свой новый профиль!
Как сделать аккаунт вк без регистрации номер телефона с помощью ваша учетная запись Facebook
Не самый простой способ, но в настоящее время применимый решение. Читайте дальше, чтобы найти пошаговую инструкцию по регистрации в ВК без регистрации. номер телефона через свой аккаунт в другой социальной сети. Запустить так:
- открыть главную страницу vk.
 com;
com; - на этой странице нажмите кнопку «Войти с Facebook»;
- для завершения регистрации разрешить платформе использовать вашу личную информацию.
Учтите, что это не совсем надежный решение, так как в процессе использования возможностей платформы вы будете часто просят пройти капчи. И через какое-то время система спросит вас для подтверждения аккаунта по номеру телефона.
регистрация ВК без телефона номер по электронной почте
Давние пользователи ВКонтакте, возможно, помнят, что несколько лет назад платформе требовался только адрес электронной почты для регистрации. К сожалению, эта опция прекращена.
В настоящее время электронная почта не используется для создания и проверки нового
счет. Однако у вас есть возможность использовать виртуальный номер для получения SMS с кодом подтверждения. Процесс быстрый и только
требуется ваша электронная почта. Что касается вашей электронной почты, мы не раскрываем ее третьим лицам,
даже администрация ВК.
Какими бы ни были ваши мотивы, любой из вышеупомянутых методов доступны. Больше не нужно раскрывать свой номер телефона. Зарегистрируйтесь как столько профилей, сколько вам нужно, чтобы наслаждаться онлайн-свободой!
Structure of the TnsB transposase-DNA complex of type V-K CRISPR-associated transposon
Introduction
The discovery of an adaptive prokaryotic immune system called C lustered R egularly I nterspaced S hort P алиндромные R epeats (CRISPR), в которых повторы связаны с Cas (CRISPR-ассоциированными) белками, произвели революцию в науках о жизни. Системы CRISPR-Cas представляют собой весьма разнообразные комплексы рибонуклеопротеинов (РНП) с разным эволюционным происхождением. Они делятся на два класса, класс 1 и класс 2, первый из которых включает многосубъединичный эффекторный комплекс, а второй — единственный белковый эффектор 9.0127 1 . Два класса далее делятся на шесть типов (I – VI) в зависимости от идентичности нуклеазного модуля и множество подтипов в зависимости от того, какие другие белки Cas присутствуют в других функциональных модулях. В частности, члены класса 2 привлекли большое внимание, поскольку они были разработаны в универсальные РНК-управляемые нуклеазы для РНК-управляемого редактирования генома, что радикально изменило науки о жизни, позволив манипулировать геномом в живых организмах 2 .
В частности, члены класса 2 привлекли большое внимание, поскольку они были разработаны в универсальные РНК-управляемые нуклеазы для РНК-управляемого редактирования генома, что радикально изменило науки о жизни, позволив манипулировать геномом в живых организмах 2 .
Недавно было обнаружено, что несколько механизмов CRISPR-Cas связаны с Tn7-подобными системами транспозонов типов I, IV и V. Эти системы CAST 3,4 являются продуктом эволюционного процесса, в ходе которого транспозоны, подобные Tn 7 , рекрутировали систему CRISPR-Cas для мобилизации транспозонов. Эти комплексы не разрушают свою ДНК-мишень и действуют исключительно на прокариотах. Они вставляют большие ДНК-грузы (10–30 т.п.н.) в определенные области генома без необходимости гомологически направленной репарации 4,5,6,7 , сочетая точность выбора сайта CRISPR-Cas с интеграционными свойствами транспозонов 8 . Поэтому считается, что CAST представляют собой очень многообещающую систему для разработки инструментов редактирования генов следующего поколения.
CAST I-F, I-B и V-K подтипы, из Vibrio cholerae (vc), Anabaena variabilis (av) и Scytonema hofmannii (sh) соответственно, были обнаружены первыми 3,4 , но недавние биоинформационные поиски метагеномных баз данных значительно расширили известный репертуар CAST до более чем 1000 неповторяющихся подсистем, представляющих Типы I, IV и V 6 . На сегодняшний день все известные CAST происходят от Tn 7 -подобных транспозонов и включают соответствующие crРНК и Cas генов, необходимых для целевого отбора 6,7 , и основной механизм транспозиции в Tn 7 -подобном локусе транспозона. Сюда входят гены TnsB, TnsC, TniQ (гомолог E. coli TnsD) и, в некоторых случаях, гены TnsA. По аналогии с системами транспозонов Tn7, белки CAST Tn 7 , как полагают, собираются в нуклеопротеиновый комплекс перед интеграцией, который включает TnsA (в типах I и IV), TnsB, TnsC и TniQ, чтобы регулировать транспозицию в инсерцию. сайт. TnsA — эндонуклеаза, расщепляющая 5′-концы транспозона 9.0127 9 и взаимодействует с TnsB, TnsC и ДНК 9,10,11 . TnsB является рекомбиназой и катализирует расщепление 3′-концов транспозона. В канонической системе Tn7 взаимодействие TnsA и TnsB необходимо для активации катализа 12 . TnsC является частью семейства AAA+ ATPase и направляет TnsA/TnsB к сайту вставки 11,13 . Считается, что взаимодействие TniQ с ДНК-мишенью, связанной комплексом CRISPR-Cas, создает искажение в структуре ДНК, позволяя TnsC распознавать как TniQ, так и ДНК 9.0127 14 и приводит к вставке транспозона в место прикрепления. Однако системы CAST типа V-K отличаются от Tn7 из-за отсутствия TnsA в их локусах. Поскольку CAST типа V-K не содержит какого-либо другого белка для замены эндонуклеазной активности TnsA, его транспозиция продуцирует коинтеграты, которые необходимо расщепить 15,16 . Разрешение коинтегратов, по-видимому, осуществляется посредством RecA-зависимой рекомбинации, как и в случае других транспозонов, лишенных фермента с 5′-эндонуклеазной активностью.
сайт. TnsA — эндонуклеаза, расщепляющая 5′-концы транспозона 9.0127 9 и взаимодействует с TnsB, TnsC и ДНК 9,10,11 . TnsB является рекомбиназой и катализирует расщепление 3′-концов транспозона. В канонической системе Tn7 взаимодействие TnsA и TnsB необходимо для активации катализа 12 . TnsC является частью семейства AAA+ ATPase и направляет TnsA/TnsB к сайту вставки 11,13 . Считается, что взаимодействие TniQ с ДНК-мишенью, связанной комплексом CRISPR-Cas, создает искажение в структуре ДНК, позволяя TnsC распознавать как TniQ, так и ДНК 9.0127 14 и приводит к вставке транспозона в место прикрепления. Однако системы CAST типа V-K отличаются от Tn7 из-за отсутствия TnsA в их локусах. Поскольку CAST типа V-K не содержит какого-либо другого белка для замены эндонуклеазной активности TnsA, его транспозиция продуцирует коинтеграты, которые необходимо расщепить 15,16 . Разрешение коинтегратов, по-видимому, осуществляется посредством RecA-зависимой рекомбинации, как и в случае других транспозонов, лишенных фермента с 5′-эндонуклеазной активностью. Тем не менее, транспозоны из семейства Tn5053, которые также лишены TnsA, но содержат гомологи для TnsB, TnsC и TniQ, могут разрешать коинтеграты с использованием кодируемой транспозоном резольвазы TniR. Может ли резольваза, кодируемая хозяином, обеспечивать эту активность в типе V-K CAST, еще предстоит определить.
Тем не менее, транспозоны из семейства Tn5053, которые также лишены TnsA, но содержат гомологи для TnsB, TnsC и TniQ, могут разрешать коинтеграты с использованием кодируемой транспозоном резольвазы TniR. Может ли резольваза, кодируемая хозяином, обеспечивать эту активность в типе V-K CAST, еще предстоит определить.
Транспозазы TnsB принадлежат к суперсемейству ретровирусных интеграз с каталитическим доменом рибонуклеазы H и мотивом активного сайта DDE. TnsB связывается с левым и правым концами транспозона и катализирует их расщепление с образованием свободных 3′-гидроксильных групп, которые позже используются в нуклеофильной атаке ниже последовательности-мишени 17 . Наконец, он выполняет реакцию переноса цепи, которая приводит к вставке груза ДНК в целевой сайт.
Транспозаза shTnsB имеет гомологию с другими членами семейства интеграз DDE, такими как E. coli TnsB, MuA и Tn5053 (дополнительный рисунок 1). Структура TnsB E. coli (ec) в комплексе с концом транспозона предоставила новые доказательства, объясняющие различия в распознавании левого и правого концов элемента 18 . Однако идентичность последовательности ecTnsB с shTnsB низкая, что затрудняет понимание деталей механизма интеграции CAST и других систем транспозонов, содержащих интегразы семейства DDE.
Однако идентичность последовательности ecTnsB с shTnsB низкая, что затрудняет понимание деталей механизма интеграции CAST и других систем транспозонов, содержащих интегразы семейства DDE.
Чтобы понять, как shTnsB способствует РНК-управляемой транспозиции в системе CAST V-K, мы определяем структуру комплекса shTnsB-ДНК, захваченного после реакции переноса цепи, с помощью крио-ЭМ с одной частицей при разрешении 2,46 Å (рис. 1). Структура показывает запутанную архитектуру белка shTnsB вокруг ДНК, образующую псевдосимметричную сборку, в которой четыре субъединицы shTnsB могут быть сгруппированы в двух разных конформациях. ДНК в каталитических карманах DDE резко изгибается после реакции переноса цепи. Сайт-направленный мутагенез и анализы транспозиции in vivo выявили важную роль в транспозиции ключевых ДНК-связывающих остатков. Комплекс реакции переноса нити shTnsB открывает новые пути к пониманию управляемой РНК транспозиции в системах CAST.
Рис. 1: Крио-ЭМ структура субъединицы CAST shTnsB, представляющая посткаталитическое состояние комплекса с переносом цепи.
1: Крио-ЭМ структура субъединицы CAST shTnsB, представляющая посткаталитическое состояние комплекса с переносом цепи. a Общая схема реакции интеграции транспозаз семейства TnsB. Активный центр DDE катализирует атаку H 2 O на концах транспозона. Прямая атака 3’ОН груза ДНК на сайт ДНК-мишени приводит к образованию комплекса переноса цепи (STC). Промежуточный продукт Шапиро разрешается репликацией, производящей дупликацию сайта-мишени и коинтеграцию 25 , который может быть разрешен с помощью RecA или резолвазы. b Архитектура белка shTnsB. c Карта плотности крио-ЭМ с глобальным разрешением 2,46 Å TnsB (STC) в посткаталитическом состоянии (см. Также дополнительные рисунки 6–7, дополнительную таблицу 2). Карта окрашена в соответствии с карикатурой, описывающей строение на панели d . д Мультфильм ШТнсБ-СТЦ. Комплекс состоит из 4 протомеров shTnsB и 6 олигонуклеотидов ДНК, представляющих посткаталитическое состояние STC (панель 9). 0197 и ). С этой точки зрения целевая ДНК расположена вверху структуры, а более длинные концы транспозона расположены внизу. На схеме отмечены непереносимая цепь (NTS) и переносимая цепь (TS) транспозона. Пунктирные линии изображают взаимодействие между MD и NTD1 из-за кривизны ветвей ДНК. e Ленточная схема, показывающая обзор узла ШТнсБ-СТЦ.
0197 и ). С этой точки зрения целевая ДНК расположена вверху структуры, а более длинные концы транспозона расположены внизу. На схеме отмечены непереносимая цепь (NTS) и переносимая цепь (TS) транспозона. Пунктирные линии изображают взаимодействие между MD и NTD1 из-за кривизны ветвей ДНК. e Ленточная схема, показывающая обзор узла ШТнсБ-СТЦ.
Полноразмерное изображение
Результаты
Выделение shTnsB и создание комплекса переноса цепи (STC)
Рекомбинантный белок shTnsB был экспрессирован в E. coli и очищен с использованием комбинации аффинной и эксклюзионной хроматографии (SEC). Белок вел себя как мономер в SEC-MALS с молекулярной массой 68 кДа (дополнительные рис. 2a, b, методы). Мы проанализировали его ДНК-связывающие свойства с помощью EMSA с использованием олигонуклеотидов с разным количеством коротких и длинных концевых повторов (SR и LTR соответственно), присутствующих на левом и правом концах (LE и RE) последовательностей транспозонов (дополнительная рис. 2c, г, дополнительная таблица 1). Анализ сдвигов полос со всеми различными субстратами выявил лестницу дискретных полос, относительная подвижность которых обратно зависела от концентрации белка, предполагая связывание одного белкового мономера на повтор. Сборки выше шести или семи белков не наблюдались, поскольку их размер препятствовал попаданию в акриламидный гель (дополнительный рисунок 2c). Затем мы проверили, может ли shTnsB независимо связывать RE или LE. Оба комплекса, shTnsB-RE и shTnsB-LE, были обнаружены, что указывает на то, что присутствие обоих концов не требуется для связывания shTnsB с повторами (дополнительный рисунок 2d). Точно так же количество полос, наблюдаемых при смешивании shTnsB с RE, соответствует 5 сайтам связывания TnsB. Однако количество полос, обнаруженных при смешивании shTnsB с LE, составило 4, т.е. на одну больше, чем ожидаемые три сайта связывания. Это можно объяснить взаимодействием двух комплексов shTnsB:LE, подобным тому, которое наблюдается в комплексе STC (рис.
2c, г, дополнительная таблица 1). Анализ сдвигов полос со всеми различными субстратами выявил лестницу дискретных полос, относительная подвижность которых обратно зависела от концентрации белка, предполагая связывание одного белкового мономера на повтор. Сборки выше шести или семи белков не наблюдались, поскольку их размер препятствовал попаданию в акриламидный гель (дополнительный рисунок 2c). Затем мы проверили, может ли shTnsB независимо связывать RE или LE. Оба комплекса, shTnsB-RE и shTnsB-LE, были обнаружены, что указывает на то, что присутствие обоих концов не требуется для связывания shTnsB с повторами (дополнительный рисунок 2d). Точно так же количество полос, наблюдаемых при смешивании shTnsB с RE, соответствует 5 сайтам связывания TnsB. Однако количество полос, обнаруженных при смешивании shTnsB с LE, составило 4, т.е. на одну больше, чем ожидаемые три сайта связывания. Это можно объяснить взаимодействием двух комплексов shTnsB:LE, подобным тому, которое наблюдается в комплексе STC (рис. 1), или в других структурах транспозазы, не связанных с ДНК-мишенью, например, в Tn5 19 . Однако агрегация комплекса shTnsB:LE также может вызывать сдвиг полосы и не может быть исключена как возможность. Наконец, мы проверили связывание shTnsB с двухцепочечной ДНК, содержащей только LTR (6)-SR (1) (дополнительный рисунок 2e), и, как и ожидалось, обнаружили две полосы, соответствующие двум сайтам связывания shTnsB. Кроме того, мы инкубировали этот комплекс в буфере, содержащем различные концентрации NaCl, при 37 и 45 °C, чтобы определить, могут ли эти переменные изменить аффинность shTnsB. Однако на ассоциацию эти изменения не повлияли. В целом, результаты EMSA показали, что shTnsB связывает каждый повтор, присутствующий как в RE, так и в LE, независимым от груза способом.
1), или в других структурах транспозазы, не связанных с ДНК-мишенью, например, в Tn5 19 . Однако агрегация комплекса shTnsB:LE также может вызывать сдвиг полосы и не может быть исключена как возможность. Наконец, мы проверили связывание shTnsB с двухцепочечной ДНК, содержащей только LTR (6)-SR (1) (дополнительный рисунок 2e), и, как и ожидалось, обнаружили две полосы, соответствующие двум сайтам связывания shTnsB. Кроме того, мы инкубировали этот комплекс в буфере, содержащем различные концентрации NaCl, при 37 и 45 °C, чтобы определить, могут ли эти переменные изменить аффинность shTnsB. Однако на ассоциацию эти изменения не повлияли. В целом, результаты EMSA показали, что shTnsB связывает каждый повтор, присутствующий как в RE, так и в LE, независимым от груза способом.
Первоначально мы подготовили сетки крио-ЭМ и собрали данные, используя образец, содержащий shTnsB, а также RE и LE (т.е. две последовательности двухцепочечной ДНК, одна с последовательностью RE и одна с последовательностью LE без груза, дополнительный рисунок 2e). Эта выборка была неоднородной и страдала преимущественной ориентацией. Обработка этих данных привела к реконструкциям с низким разрешением недостаточного качества для построения модели атома (дополнительный рисунок 3). Однако можно было наблюдать два выступа, связанных с удлиненной плотностью, что свидетельствует о присутствии двух протомеров shTnsB, связанных с поверхностью двухцепочечной ДНК набора SR-LTR. Удлиненная плотность, приписываемая ДНК, изгибается таким же образом, как в недавно опубликованной структуре RE-связанного ecTnsB 9.0127 18 , что также подтверждает, что карта с низким разрешением соответствует комплексу перед транспозицией.
Эта выборка была неоднородной и страдала преимущественной ориентацией. Обработка этих данных привела к реконструкциям с низким разрешением недостаточного качества для построения модели атома (дополнительный рисунок 3). Однако можно было наблюдать два выступа, связанных с удлиненной плотностью, что свидетельствует о присутствии двух протомеров shTnsB, связанных с поверхностью двухцепочечной ДНК набора SR-LTR. Удлиненная плотность, приписываемая ДНК, изгибается таким же образом, как в недавно опубликованной структуре RE-связанного ecTnsB 9.0127 18 , что также подтверждает, что карта с низким разрешением соответствует комплексу перед транспозицией.
Чтобы стабилизировать комплекс shTnsB-ДНК, мы разработали олигонуклеотиды для восстановления STC, то есть состояния, представляющего посттранспозицию, а не претранспозицию, как описано выше (Методы, дополнительная таблица 1 и дополнительная рис. 4). Целевые последовательности для восстановленного комплекса были выбраны на основе природных последовательностей, фланкирующих сайт прикрепления в геноме S. hofmannii UTEX 2349. Эта стратегия аналогична стратегии получения транспозосомной структуры Р-элемента 20 , за исключением того, что в ней используется не симметричная ДНК STC, а природные асимметричные последовательности STC S. hofmannii UTEX 2349 , чтобы представить родной комплекс. ДНК STC состоит из двух перенесенных цепей (TS) и неперенесенных цепей (NTS), представляющих LTR(8)-SR(5) и SR(1)-LTR(6) двухцепочечную ДНК, связанную с сайтом прикрепления CAST (дополнительная рис. 4). Расстояние 5 п.н. между сайтами вставки LTR(8)-SR(5) и SR(1)-LTR(6) было выбрано, поскольку транспозиция CAST вызывает дупликацию 5 п.н. в сайте вставки 9.0127 21 (рис. 1а).
hofmannii UTEX 2349. Эта стратегия аналогична стратегии получения транспозосомной структуры Р-элемента 20 , за исключением того, что в ней используется не симметричная ДНК STC, а природные асимметричные последовательности STC S. hofmannii UTEX 2349 , чтобы представить родной комплекс. ДНК STC состоит из двух перенесенных цепей (TS) и неперенесенных цепей (NTS), представляющих LTR(8)-SR(5) и SR(1)-LTR(6) двухцепочечную ДНК, связанную с сайтом прикрепления CAST (дополнительная рис. 4). Расстояние 5 п.н. между сайтами вставки LTR(8)-SR(5) и SR(1)-LTR(6) было выбрано, поскольку транспозиция CAST вызывает дупликацию 5 п.н. в сайте вставки 9.0127 21 (рис. 1а).
Восстановленная ДНК STC была смешана с очищенным белком, и сборка комплекса shTnsB-STC была проверена с помощью SEC-MALS (дополнительная рис. 2b). Наблюдали два пика: пик с более низкой молекулярной массой содержал несвязанный белок и ДНК, использованные при восстановлении, в то время как пик с высокой молекулярной массой, который элюировался при 358,7 кДа, очень хорошо совпадал с ассоциацией ДНК STC (104,6 кДа) и 4 протомеров shTnsB (68 кДа), теоретическая молекулярная масса которого составляет 376,6 кДа. Эта сборка была подвергнута анализу отдельных частиц с помощью крио-ЭМ, в результате чего была получена карта с разрешением 2,46 Å, на которой мы построили атомную модель комплекса shTnsB-STC в его посткаталитическом состоянии (рис. 1а).
Эта сборка была подвергнута анализу отдельных частиц с помощью крио-ЭМ, в результате чего была получена карта с разрешением 2,46 Å, на которой мы построили атомную модель комплекса shTnsB-STC в его посткаталитическом состоянии (рис. 1а).
Общая структура комплекса shTnsB-STC
Полипептид shTnsB состоит из N-концевого домена, который можно разделить на два субдомена (NTD1 и NTD2), каталитического домена DDE (DDE), среднего домена (MD) , домен олигомеризации (OD) и С-концевой домен (CTD) (рис. 1b). Архитектура shTnsB напоминает архитектуру Mu-транспозазы (MuA) 22 , хотя идентичность последовательности ограничена каталитическим доменом DDE (дополнительный рисунок 1a). Мы собрали 4728 фильмов и установили координаты для 90,6 миллиона частиц, которые были уменьшены до 415 тысяч после 2D-классификации. Используя этот набор частиц, мы выполнили неравномерное уточнение, трехмерный анализ изменчивости и последующее гетерогенное уточнение в cryoSPARC 23 . Этот подход дал две карты на 2,5 и 2,8 Å. Дальнейшие этапы уточнения и трехмерного анализа изменчивости с использованием 260 тыс. частиц карты 2,5 Å позволили создать крио-ЭМ-карту с глобальным разрешением 2,46 Å, что позволило смоделировать комплекс shTnsB-STC (рис. 1c, дополнительные рис. 5–7, Дополнительная таблица 2 и методы). Однако большая гибкость ДНК поставила под угрозу визуализацию концов ДНК, содержащих SR (5) и SR (1), что не позволило определить возможные контакты с shTnsB (дополнительный рисунок 7, дополнительный фильм 1 и дополнительная таблица 1).
Этот подход дал две карты на 2,5 и 2,8 Å. Дальнейшие этапы уточнения и трехмерного анализа изменчивости с использованием 260 тыс. частиц карты 2,5 Å позволили создать крио-ЭМ-карту с глобальным разрешением 2,46 Å, что позволило смоделировать комплекс shTnsB-STC (рис. 1c, дополнительные рис. 5–7, Дополнительная таблица 2 и методы). Однако большая гибкость ДНК поставила под угрозу визуализацию концов ДНК, содержащих SR (5) и SR (1), что не позволило определить возможные контакты с shTnsB (дополнительный рисунок 7, дополнительный фильм 1 и дополнительная таблица 1).
Структура комплекса shTnsB-STC напоминает удлиненный X с изогнутыми плечами разной длины. Более длинные плечи соответствуют концам транспозона, а короткие — изогнутой ДНК-мишени (рис. 1г, д, 2а). Четыре протомера shTnsB (shTnsB1-4) представляют собой переплетенную сборку на ДНК STC. Белок находится в двух разных конформациях, чтобы ассоциироваться с ДНК STC и строить комплекс (рис. 2b). shTnsB1 и 2 изображают вытянутую конформацию вдоль разветвленной структуры нуклеиновой кислоты, в которой мы не смогли обнаружить домены OD и CTD (рис. 1б, г). В обоих протомерах каждый из доменов NTD1 и NTD2 связан с LTR(8) и LTR(6), а каталитический домен DDE визуализируется в транс-положении на стыке ДНК-мишени и концов транспозона. Такое расположение каталитического домена в транс-положении является обычным при транспозиции ДНК, поскольку оно делает расщепление фосфодиэфира зависимым от сборки комплекса (рис. 1e, 2b). Со стороны ДНК-мишени сборка стабилизируется за счет взаимодействия остова с доменами MD и DDE протомеров shTnsB1 и 2 (R416, Q427, K29).0, N428) (рис. 2б). Таким образом, shTnsB1 осуществляет распознавание ДНК на конце LTR(8), а его домен DDE катализирует атаку 3´OH в ответвлении LTR(6) на ДНК-мишень, способствуя реакции переноса цепи. Симметричное расположение ДНК STC наблюдается для shTnsB2, который катализирует перенос цепи LTR(8) на другую цепь ДНК-мишени (рис. 1а, 2б).
1б, г). В обоих протомерах каждый из доменов NTD1 и NTD2 связан с LTR(8) и LTR(6), а каталитический домен DDE визуализируется в транс-положении на стыке ДНК-мишени и концов транспозона. Такое расположение каталитического домена в транс-положении является обычным при транспозиции ДНК, поскольку оно делает расщепление фосфодиэфира зависимым от сборки комплекса (рис. 1e, 2b). Со стороны ДНК-мишени сборка стабилизируется за счет взаимодействия остова с доменами MD и DDE протомеров shTnsB1 и 2 (R416, Q427, K29).0, N428) (рис. 2б). Таким образом, shTnsB1 осуществляет распознавание ДНК на конце LTR(8), а его домен DDE катализирует атаку 3´OH в ответвлении LTR(6) на ДНК-мишень, способствуя реакции переноса цепи. Симметричное расположение ДНК STC наблюдается для shTnsB2, который катализирует перенос цепи LTR(8) на другую цепь ДНК-мишени (рис. 1а, 2б).
a На верхней панели показана схема S. hofmannii подвижный элемент с левым и правым концами (LE и RE) с каждой стороны груза ДНК. Сильный цветовой тон показывает область каждого элемента, присутствующего в структуре. Нижняя панель не включает белковые фрагменты в структуру и показывает ДНК STC. ДНК окрашена по верхней схеме для LE и RE, а участок ДНК-мишени показан серым цветом. Желтые точки указывают сайт, где произошла прямая атака 3′-ОН на ДНК-мишень, чтобы способствовать реакции переноса цепи. b Подробное изображение ассоциации протомера shTnsB с ДНК STC. Две различные ассоциации наблюдаются для молекул shTnsB. Различные участки ДНК, взаимодействующие с белками, показаны соответствующим ярким цветовым оттенком. c Подробное изображение спиральных доменов NTD1 и 2, показывающее специфические взаимодействия с основаниями ДНК в области LTR(6). Маркировка нуклеотидов соответствует цветовому коду на рис. 1d, e (см. также рис. 1d и дополнительный рис. 8).
Сильный цветовой тон показывает область каждого элемента, присутствующего в структуре. Нижняя панель не включает белковые фрагменты в структуру и показывает ДНК STC. ДНК окрашена по верхней схеме для LE и RE, а участок ДНК-мишени показан серым цветом. Желтые точки указывают сайт, где произошла прямая атака 3′-ОН на ДНК-мишень, чтобы способствовать реакции переноса цепи. b Подробное изображение ассоциации протомера shTnsB с ДНК STC. Две различные ассоциации наблюдаются для молекул shTnsB. Различные участки ДНК, взаимодействующие с белками, показаны соответствующим ярким цветовым оттенком. c Подробное изображение спиральных доменов NTD1 и 2, показывающее специфические взаимодействия с основаниями ДНК в области LTR(6). Маркировка нуклеотидов соответствует цветовому коду на рис. 1d, e (см. также рис. 1d и дополнительный рис. 8).
Изображение полного размера
Протомеры shTnsB3 и 4 расположены в другой конформации с небольшим количеством контактов с остовом ДНК (рис. 2б). Домены NTD1 и NTD2 этих протомеров не обнаружены в нашей структуре, что свидетельствует об их высокой подвижности. Кроме того, домен DDE вытягивается из ДНК, в то время как MD размещает области NTS с концов LTR (6) и LTR (8) после катализа. Структура выявила важную роль этих двух протомеров в ассоциации shTnsB1 и shTnsB2 с ДНК, поскольку в этой конформации они демонстрируют упорядоченный домен OD. Спираль между S502 и S522 не наблюдается в shTnsB1-2, но в конформации, принятой shTnsB3-4, спираль облегчает сборку комплекса STC за счет переплетения NTD2 shTnsB1 и shTnsB2 с доменом DDE противоположного протомера. в каждой ветви ДНК, тем самым связывая распознавание двух концов транспозона с каталитическими сайтами shTnsB1-2 (рис. 1d, 2b).
2б). Домены NTD1 и NTD2 этих протомеров не обнаружены в нашей структуре, что свидетельствует об их высокой подвижности. Кроме того, домен DDE вытягивается из ДНК, в то время как MD размещает области NTS с концов LTR (6) и LTR (8) после катализа. Структура выявила важную роль этих двух протомеров в ассоциации shTnsB1 и shTnsB2 с ДНК, поскольку в этой конформации они демонстрируют упорядоченный домен OD. Спираль между S502 и S522 не наблюдается в shTnsB1-2, но в конформации, принятой shTnsB3-4, спираль облегчает сборку комплекса STC за счет переплетения NTD2 shTnsB1 и shTnsB2 с доменом DDE противоположного протомера. в каждой ветви ДНК, тем самым связывая распознавание двух концов транспозона с каталитическими сайтами shTnsB1-2 (рис. 1d, 2b).
Распознавание shTnsB-ДНК
Распознавание LTR(6) и LTR(8) осуществляется спиральными доменами NTD1 и 2 субъединиц shTnsB1 и 2 (рис. 2c). Структура домена NTD1 обнаруживает спираль-поворот-спираль Myb/гомеодомен-подобную складку. Этот домен является членом надсемейства гомеобоксных факторов транскрипции 24 . Прямые контакты оснований с помощью спирали, связывающей большую бороздку, в основном объясняют специфичное для последовательности распознавание. R77, который хорошо консервативен в гомологах цианобактерий и в Tn5053, но заменен лизином в MuA и аланином в ecTnsB (дополнительный рисунок 1), образует полярные контакты с dG37, тогда как R81 связывается с основаниями последовательных нуклеотидов dG36 и dT37. на комплементарной цепи LTR (6) в LE (дополнительные рис. 7, 8 и дополнительная таблица 1). Другие остатки, взаимодействующие с ДНК (R58, R66, K84 и T78), обнаруживают полярные взаимодействия с остовом обеих цепей ДНК.
Прямые контакты оснований с помощью спирали, связывающей большую бороздку, в основном объясняют специфичное для последовательности распознавание. R77, который хорошо консервативен в гомологах цианобактерий и в Tn5053, но заменен лизином в MuA и аланином в ecTnsB (дополнительный рисунок 1), образует полярные контакты с dG37, тогда как R81 связывается с основаниями последовательных нуклеотидов dG36 и dT37. на комплементарной цепи LTR (6) в LE (дополнительные рис. 7, 8 и дополнительная таблица 1). Другие остатки, взаимодействующие с ДНК (R58, R66, K84 и T78), обнаруживают полярные взаимодействия с остовом обеих цепей ДНК.
NTD1 соединен с NTD2 длинной петлей, которая проходит вдоль бороздки ДНК. Домен NTD2 функционально аналогичен второму ДНК-связывающему домену в других транспозазах. Однако он демонстрирует ограниченную консервативность по отношению к ближайшим гомологам shTnsB (дополнительный рисунок 1), а его структура напоминает парный домен, обнаруженный в генах парного ящика (Pax). Хорошо консервативный R99 в этой петле создает полярные взаимодействия с основаниями dT31 и dA32 и dA45, в то время как R106 также распознает основания dT30 и dT46 в разных цепях. Остальные ассоциации петли с ДНК включают остовные контакты. Домен NTD2 также связывается с ДНК в большой бороздке. Однако он отображает меньше конкретных контактов с базами. Только R158 и K154 связаны с dA48-dG49.и dG24 соответственно, тогда как остальные остатки связаны с остовом нуклеиновой кислоты. Эти взаимодействия аналогичны в доменах NTD1 и 2 на ветвях LTR (6) и LTR (8) комплекса белок-ДНК (дополнительная рис. 7).
Хорошо консервативный R99 в этой петле создает полярные взаимодействия с основаниями dT31 и dA32 и dA45, в то время как R106 также распознает основания dT30 и dT46 в разных цепях. Остальные ассоциации петли с ДНК включают остовные контакты. Домен NTD2 также связывается с ДНК в большой бороздке. Однако он отображает меньше конкретных контактов с базами. Только R158 и K154 связаны с dA48-dG49.и dG24 соответственно, тогда как остальные остатки связаны с остовом нуклеиновой кислоты. Эти взаимодействия аналогичны в доменах NTD1 и 2 на ветвях LTR (6) и LTR (8) комплекса белок-ДНК (дополнительная рис. 7).
Сборка комплекса белок-ДНК
Домены NTD2 субъединиц shTnsB1-2 соединены с доменами DDE длинной петлей. Переплетающаяся конформация этих протомеров с ДНК позволяет shTnsB1, который распознает ДНК в LTR(8), катализировать реакцию переноса цепи на конце LTR(6), и наоборот для shTnsB2 (рис. 1c, 2b). Этому перекрестному расположению каталитических доменов DDE способствует конформация молекул shTnsB3-4, которые стабилизируют сборку за счет интеркалирования длинной двудольной спирали, которая собирает домены NTD2 и DDE разных субъединиц. Соседний MD вмещает 5 ′ NTS (рис. 1d, рис. 3a–c). С-концевая спираль OD плотно прилегает между доменом DDE shTnsB2 и NTD2 shTnsB1 сетью контактов, сочетающих полярные и неполярные взаимодействия (рис. 3b), причем первая на конце (E360-K520 ), средний (R367-D512-Q508) и начальный (h372-S505) участки спирали. Другое сильное полярное взаимодействие наблюдается между боковыми цепями D514 в OD и R137 в NTD2. Короткая петля соединяет этот участок с N-концевой спиралью OD. Взаимодействие второй спирали OD с доменом DDE стабилизируется за счет неполярных взаимодействий, а группа остатков в MD shTnsB3 (R416, Q425, N428) вместе с R174 и R179в shTnsB2 образуют электроположительно заряженную область, стабилизирующую основания 5′-выступа (рис. 3c). Наконец, домены MD и DDE протомера shTnsB3 связаны с NTD1 shTnsB2, главным образом, группой неполярных взаимодействий. Интересно, что N-концевая β-цепь shTnsB2 встроена в качестве дополнительной цепи в антипараллельный β-лист MD (рис. 3d). Дополнительные полярные взаимодействия боковых цепей (E422-K169, N462-K102 и E54-h383) дополняют эту ассоциацию.
Соседний MD вмещает 5 ′ NTS (рис. 1d, рис. 3a–c). С-концевая спираль OD плотно прилегает между доменом DDE shTnsB2 и NTD2 shTnsB1 сетью контактов, сочетающих полярные и неполярные взаимодействия (рис. 3b), причем первая на конце (E360-K520 ), средний (R367-D512-Q508) и начальный (h372-S505) участки спирали. Другое сильное полярное взаимодействие наблюдается между боковыми цепями D514 в OD и R137 в NTD2. Короткая петля соединяет этот участок с N-концевой спиралью OD. Взаимодействие второй спирали OD с доменом DDE стабилизируется за счет неполярных взаимодействий, а группа остатков в MD shTnsB3 (R416, Q425, N428) вместе с R174 и R179в shTnsB2 образуют электроположительно заряженную область, стабилизирующую основания 5′-выступа (рис. 3c). Наконец, домены MD и DDE протомера shTnsB3 связаны с NTD1 shTnsB2, главным образом, группой неполярных взаимодействий. Интересно, что N-концевая β-цепь shTnsB2 встроена в качестве дополнительной цепи в антипараллельный β-лист MD (рис. 3d). Дополнительные полярные взаимодействия боковых цепей (E422-K169, N462-K102 и E54-h383) дополняют эту ассоциацию. В целом, описанные здесь ассоциации очень похожи в случае shTnsB4 с shTnsB1 и 2. Отметим, что взаимодействия между shTnsB3 и 4 в комплексе shTnsB-STC не наблюдается.
В целом, описанные здесь ассоциации очень похожи в случае shTnsB4 с shTnsB1 и 2. Отметим, что взаимодействия между shTnsB3 и 4 в комплексе shTnsB-STC не наблюдается.
a Обзор архитектуры протомеров shTnsB и взаимодействий между двумя типами конформаций, наблюдаемых для белка на одной из ветвей ДНК STC (прозрачно). Цветные овалы обозначают увеличенные области на других панелях. b , c Подробное изображение взаимодействий OD shTnsB3 с доменами NTD2 и DDE shTnsB1 и 2 соответственно. д Увеличение области LTR(6), изображающей ассоциацию N-концевого β-листа NTD1 с MD shTnsB3.
Изображение в полный размер
В совокупности эта сеть взаимодействий вдоль Х-образного комплекса предполагает, что различная конформация протомеров shTnsB1-2 и shTnsB3-4 благоприятствует транс-архитектуре, скорее всего, как стратегии связывания белок-ДНК. комплексная сборка с катализом ДДЕ.
Каталитический домен DDE
Транспозазы из нескольких суперсемейств обладают каталитическим доменом, содержащим триаду кислых аминокислот (DDE или DDD) 25,26 . Этот белковый модуль катализирует реакцию транспозиции, при которой элемент вырезается из донорского сайта и вставляется в геном или в мобильный генетический элемент. Мутации в этих каталитических остатках показали их критическую роль в транспозиции в доменах DDE транспозаз Tn5 и Tn10 27,28 . Интеграция элементов в новое место генома обычно приводит к короткой дупликации сайта-мишени из последовательностей хозяина (2–10 п.н.). В shTnsB мотив DDE состоит из двух остатков аспарагиновой кислоты (D205, D287) и остатка глутаминовой кислоты (E321), расположенных в консервативном ядре, образующем характерную РНКазу Н-подобную складку, объединяющую α-спирали и β-цепи (рис. 4а, дополнительный рис. 8е). Трехмерная структура триады ДДЭ образует каталитический карман, который связывается с ионами двухвалентного металла, которые помогают в различных нуклеофильных реакциях во время расщепления ДНК. Домены DDE четырех молекул shTnsB в сборке очень хорошо накладываются друг на друга (среднеквадратичное отклонение 0,59).Å среднеквадратичное значение более 160 Cα). Однако карман DDE демонстрирует два разных расположения в зависимости от конформации протомера shTnsB в комплексе STC (рис. 1). Карманы DDE shTnsB3 и 4 не контактируют с ДНК, и каталитические остатки этих субъединиц не расположены должным образом для реакции расщепления (рис. 4b). В случае shTnsB1 и 2 они обнаруживают каталитический карман DDE после завершения реакции переноса цепи. Можно визуализировать дополнительную плотность в кармане (рис. 4а), которую можно отнести к H 2 O или Mg 2+ . E321 находится на расстоянии 6 Å, так как структура захватывается в посткаталитическом состоянии. Расстояния дополнительной плотности до D205, D287 и фосфатов основной цепи позволяют предположить, что плотность может быть отнесена к молекуле H 2 O, образующейся после 3′-OH-атаки одной из цепей мобильного элемента на ДНК-мишень.
Домены DDE четырех молекул shTnsB в сборке очень хорошо накладываются друг на друга (среднеквадратичное отклонение 0,59).Å среднеквадратичное значение более 160 Cα). Однако карман DDE демонстрирует два разных расположения в зависимости от конформации протомера shTnsB в комплексе STC (рис. 1). Карманы DDE shTnsB3 и 4 не контактируют с ДНК, и каталитические остатки этих субъединиц не расположены должным образом для реакции расщепления (рис. 4b). В случае shTnsB1 и 2 они обнаруживают каталитический карман DDE после завершения реакции переноса цепи. Можно визуализировать дополнительную плотность в кармане (рис. 4а), которую можно отнести к H 2 O или Mg 2+ . E321 находится на расстоянии 6 Å, так как структура захватывается в посткаталитическом состоянии. Расстояния дополнительной плотности до D205, D287 и фосфатов основной цепи позволяют предположить, что плотность может быть отнесена к молекуле H 2 O, образующейся после 3′-OH-атаки одной из цепей мобильного элемента на ДНК-мишень. (рис. 1а, 4а, дополнительный рис. 8).
(рис. 1а, 4а, дополнительный рис. 8).
a В обведенной области находится один из каталитических центров в комплексе shTnsB-STC. Увеличение области показывает конформацию каталитического центра после катализа. Предполагаемая молекула воды и расстояния до соседних каталитических остатков и ДНК показаны в Å. b Наложение доменов DDE двух конформаций, обнаруженных в комплексе белок-ДНК для shTnsB. c Суперпозиция доменов DDE shTnsB2 и 3 с ecTnsB (PDB: 7PIK) и коровым доменом MuA (PDB: 1BCO). СКО для суперпозиции находятся в диапазоне от 0,7 до 1,2 Å для 160 и 250 Cα. d Нижняя панель показывает, что, несмотря на высокое структурное сходство доменов DDE, единственной субъединицей во всех этих структурах, которая демонстрирует компетентный каталитический карман, является shTnsB2, которая является единственной, связанной с ДНК.
Изображение в натуральную величину
Несмотря на различия в последовательностях, современная структура комплекса распознавания концов транспозона Tn7 ecTnsB транспозазы 18 обеспечивает функциональный гомолог для сравнения. Домен DDE является наиболее консервативным модулем shTnsB, и поиск гомологов shTnsB DDE с использованием DALI 29 выявил домены ecTnsB и транспозазы фага Mu как наиболее близкие структурные гомологи вместе с различными вирусными интегразами (SRV, HIV- 1, ВТЛВ-1). Сравнение двух конформаций shTnsB с этими белками показало, что ядро домена очень хорошо накладывалось на другие интегразы (рис. 4c), но только каталитический карман shTnsB1-2 показал триаду кислых аминокислот на соответствующих расстояниях для катализа реакция переноса цепи (рис. 4d). В остальных случаях каталитические остатки не были правильно расположены. Примечательно, что протомеры ecTnsB в комплексе распознавания концов имеют конформацию, сходную с протомерами shTnsB3 и 4 в STC. Однако в последнем ДНК-связывающие домены этих двух субъединиц не визуализировались (рис. 1–2), что позволяет предположить, что высокая гибкость, наблюдаемая в дистальных отделах ДНК STC (дополнительный фильм 1), нарушает их связывание с SR(1) и SR(5) области LE и RE.
Домен DDE является наиболее консервативным модулем shTnsB, и поиск гомологов shTnsB DDE с использованием DALI 29 выявил домены ecTnsB и транспозазы фага Mu как наиболее близкие структурные гомологи вместе с различными вирусными интегразами (SRV, HIV- 1, ВТЛВ-1). Сравнение двух конформаций shTnsB с этими белками показало, что ядро домена очень хорошо накладывалось на другие интегразы (рис. 4c), но только каталитический карман shTnsB1-2 показал триаду кислых аминокислот на соответствующих расстояниях для катализа реакция переноса цепи (рис. 4d). В остальных случаях каталитические остатки не были правильно расположены. Примечательно, что протомеры ecTnsB в комплексе распознавания концов имеют конформацию, сходную с протомерами shTnsB3 и 4 в STC. Однако в последнем ДНК-связывающие домены этих двух субъединиц не визуализировались (рис. 1–2), что позволяет предположить, что высокая гибкость, наблюдаемая в дистальных отделах ДНК STC (дополнительный фильм 1), нарушает их связывание с SR(1) и SR(5) области LE и RE.
В совокупности структурное сравнение показывает, что домен DDE поддерживает очень хорошо сохранившуюся трехмерную структуру; однако сравнение различных структурных гомологов предполагает, что архитектура каталитического кармана транспозазы устроена правильно, как только она связывается с ДНК-мишенью.
Связывание ДНК транспозазами shTnsB, ecTnsB и MuA
Белок shTnsB проявляет гомологию с транспозазами ecTnsB и MuA. Однако, помимо домена DDE, между ними сохраняется несколько остатков (дополнительный рисунок 1). Эти различия особенно очевидны в ДНК-связывающих доменах, где многочисленные выравнивания последовательностей из нескольких канонических белков Tn7 TnsB и различных классов CAST-элементов показали существенное расхождение 18 . NTD1 shTnsB демонстрирует значительное трехмерное сходство с доменом HTH DBD1 в ecTnsB (RMSD 2,4 Å для 66 Cα) и доменом Iβ MuA (RMSD 2,8 Å для 62 Cα). Тем не менее, присутствие N-концевой β-цепи (N32-T36) исключает shTnsB, и эта область играет важную роль в построении сборки комплекса STC (рис. 3d). Эта структурная особенность не наблюдается в комплексе MuA-STC 22 , единственной доступной до сих пор структуре прокариотического комплекса транспозазы STC (рис. 5).
3d). Эта структурная особенность не наблюдается в комплексе MuA-STC 22 , единственной доступной до сих пор структуре прокариотического комплекса транспозазы STC (рис. 5).
ДНК-связывающие домены трех различных транспозаз выровнены по ДНК (PDB: 8AA5, 7PIK и 4FCY соответственно). В случае MuA показаны одни и те же домены, связанные с разными повторами. Для shTnsB были построены только домены протомеров 1 и 2. В случае ecTnsB изображен ДНК-связывающий домен одной из субъединиц концевого комплекса транспозона.
Полноразмерное изображение
Интересно, что домен NTD2 shTnsB не проявляет трехмерного сходства с его аналогами доменов в транспозазах ecTnsB и MuA (рис. 5). Вместо этого NTD2 хорошо накладывается на Pax6, фактор транскрипции, содержащий двудольный парный ДНК-связывающий домен (RMSD 2,8 Å для 60 Cα), который играет критическую роль в развитии глаза, носа, поджелудочной железы и центральной нервной системы 30 . Удлиненный линкер, соединяющий NTD1 и 2, частично визуализируется в ecTnsB и не наблюдается в ДНК-связывающих доменах MuA (рис. 5). Этот линкер образует контакты малой бороздки, а карбоксиконцевая единица спираль-поворот-спираль образует контакты основания в большой бороздке, как это наблюдается в комплексе shTnsB-STC (рис. 5).
Удлиненный линкер, соединяющий NTD1 и 2, частично визуализируется в ecTnsB и не наблюдается в ДНК-связывающих доменах MuA (рис. 5). Этот линкер образует контакты малой бороздки, а карбоксиконцевая единица спираль-поворот-спираль образует контакты основания в большой бороздке, как это наблюдается в комплексе shTnsB-STC (рис. 5).
Сравнение позволяет предположить, что белки TnsB имеют общий общий способ связывания ДНК, включая два домена, которые распознают разные SR и LTR в сборке. Однако домены, участвующие в связывании, претерпевают различные структурные изменения для осуществления специфических взаимодействий белок-ДНК для каждой транспозазы. Это разнообразие может быть необходимо для размещения последовательностей большого количества Tn7-подобных элементов, предотвращая распознавание транспозазами последовательностей ДНК, принадлежащих другим транспозонам 31 .
Комплексы STC
Структура концевого комплекса транспозона ecTnsB предоставила информацию о распознавании концов транспозона 18 , но до сих пор нет структурной информации об их комплексе STC. Конформация субъединиц ecTnsB в концевом комплексе транспозона напоминает расположение, принятое доменом DDE протомеров shTnsB3 и 4 в комплексе shTnsB-STC. Однако положения доменов MD и OD ориентированы по-разному (рис. 4c). Тем не менее, эта конформация сильно отличается от архитектуры протомеров 1 и 2 shTnsB, которые участвуют в катализе реакции переноса цепи (рис. 2b). Конформация этих субъединиц больше похожа на аналоги в комплексе MuA-STC (рис. 6а).
Конформация субъединиц ecTnsB в концевом комплексе транспозона напоминает расположение, принятое доменом DDE протомеров shTnsB3 и 4 в комплексе shTnsB-STC. Однако положения доменов MD и OD ориентированы по-разному (рис. 4c). Тем не менее, эта конформация сильно отличается от архитектуры протомеров 1 и 2 shTnsB, которые участвуют в катализе реакции переноса цепи (рис. 2b). Конформация этих субъединиц больше похожа на аналоги в комплексе MuA-STC (рис. 6а).
a Комплексы shTnsB-STC и MuA-STC показаны в той же цветовой схеме, что и на рис. 1, за исключением ДНК, окрашенной в белый цвет. b Обведенные кружками области на обоих комплексах сравниваются, чтобы показать ключевые различия в сборке комплексов STC.
Изображение в полный размер
Хотя последовательность shTnsB отдаленно связана с транспозазой фага MuA (дополнительная рис. 1), общая ассоциация комплекса MuA-STC имеет сходство с белком CAST (рис. 6a). Однако сборка также имеет важные отличия. Одно из основных отличий заключается в том, что в комплексе MuA-STC ДНК-связывающие домены субъединиц, участвующих в сборке (MuA 3 и 4), связаны с соответствующими повторами в LE и RE (рис. 6а), тогда как в шТнсБ-СТЦ их нельзя было смоделировать, что свидетельствует об их высокой гибкости. Это мнение подтверждается высокой изменчивостью, наблюдаемой во внешней части Х-образной структуры ДНК (дополнительный фильм 1). Тот факт, что эти области структуры MuA-STC 22 участвуют в кристаллических контактах, могут снижать гибкость, облегчая тем самым связывание доменов Iβ и Iγ с повторами на LE и RE концах.
6a). Однако сборка также имеет важные отличия. Одно из основных отличий заключается в том, что в комплексе MuA-STC ДНК-связывающие домены субъединиц, участвующих в сборке (MuA 3 и 4), связаны с соответствующими повторами в LE и RE (рис. 6а), тогда как в шТнсБ-СТЦ их нельзя было смоделировать, что свидетельствует об их высокой гибкости. Это мнение подтверждается высокой изменчивостью, наблюдаемой во внешней части Х-образной структуры ДНК (дополнительный фильм 1). Тот факт, что эти области структуры MuA-STC 22 участвуют в кристаллических контактах, могут снижать гибкость, облегчая тем самым связывание доменов Iβ и Iγ с повторами на LE и RE концах.
Любопытно, что ассоциация уникальной N-концевой β-цепи NTD1 в shTnsB не наблюдается в MuA (рис. 6а, б, верхние панели), поскольку этот элемент вторичной структуры отсутствует ни в домене Iβ MuA, ни в DBD1 ecTnsB. Это наблюдение предполагает, что в комплексе ecTnsB-STC эта ассоциация не может происходить. Другое важное отличие возникает из-за сборки комплекса, в котором домен OD в shTnsB интеркалирует с множественными взаимодействиями между NTD2 и каталитическим доменом DDE, создавая ассоциацию между белками shTnsB. В случае MuA ассоциация между четырьмя протомерами в этой области комплекса STC отличается, демонстрируя значительно меньше взаимодействий между разными доменами (рис. 6b). Кроме того, в протомерах 1 и 2 комплекса shTnsB-STC домены OD не наблюдаются, тогда как в случае MuA спирали в домене IIIα перекрещиваются внутри V-образного участка ДНК-мишени (рис. 6а). ). Нельзя было не учитывать возможность того, что взаимодействие между этими спиралями в структуре MuA происходит за счет кристаллических контактов.
В случае MuA ассоциация между четырьмя протомерами в этой области комплекса STC отличается, демонстрируя значительно меньше взаимодействий между разными доменами (рис. 6b). Кроме того, в протомерах 1 и 2 комплекса shTnsB-STC домены OD не наблюдаются, тогда как в случае MuA спирали в домене IIIα перекрещиваются внутри V-образного участка ДНК-мишени (рис. 6а). ). Нельзя было не учитывать возможность того, что взаимодействие между этими спиралями в структуре MuA происходит за счет кристаллических контактов.
Эффект связывания ДНК при транспозиции
Чтобы подтвердить взаимодействие shTnsB:ДНК в STC, мы протестировали транспозиционную активность ряда мутантов с заменой, в которых консервативные аминокислоты, демонстрирующие полярные взаимодействия с ДНК, были заменены аланином (рис. 7, дополнительный рис. 1). Мы мутировали R77, R81 (оба присутствуют в NTD1), R99 (присутствуют в линкере между NTD1 и NTD2), R158 (присутствуют в NTD2), R188, R223, K290 и R380 (присутствуют в домене DDE) (рис. 7b). . Мутанты R77A, R81A и R158A продемонстрировали резкое влияние на активность транспозиции «на-мишень», предполагая, что shTnsB больше не может распознавать повторы в RE и LE (рис. 7b). Примечательно, что нуклеотиды, участвующие в этом взаимодействии (дополнительная рис. 7), сохраняются между различными повторами, что еще раз подтверждает важность этого взаимодействия в распознавании ДНК донора 21 . Что касается R99, хотя он и присутствует в неупорядоченной области shTnsB, он тесно взаимодействует с фосфатным остовом и основаниями LTR. Эти нуклеотиды также сохраняются в наборе повторов RE/LE 21 . Однако эффект его замены был переменным: повторы демонстрировали либо более высокую, либо более низкую активность, чем дикий тип. В случае R223A и R380A это также повлияло на активность. Эти остатки, по-видимому, участвуют в стабилизации состояния после транспозиции. R223 взаимодействует с центральными нуклеотидами последовательности 5 bp между никами, образованными транспозицией, тогда как R380 взаимодействует с нерасщепленной одноцепочечной ДНК транспозона, расположенной вне комплекса.
7b). . Мутанты R77A, R81A и R158A продемонстрировали резкое влияние на активность транспозиции «на-мишень», предполагая, что shTnsB больше не может распознавать повторы в RE и LE (рис. 7b). Примечательно, что нуклеотиды, участвующие в этом взаимодействии (дополнительная рис. 7), сохраняются между различными повторами, что еще раз подтверждает важность этого взаимодействия в распознавании ДНК донора 21 . Что касается R99, хотя он и присутствует в неупорядоченной области shTnsB, он тесно взаимодействует с фосфатным остовом и основаниями LTR. Эти нуклеотиды также сохраняются в наборе повторов RE/LE 21 . Однако эффект его замены был переменным: повторы демонстрировали либо более высокую, либо более низкую активность, чем дикий тип. В случае R223A и R380A это также повлияло на активность. Эти остатки, по-видимому, участвуют в стабилизации состояния после транспозиции. R223 взаимодействует с центральными нуклеотидами последовательности 5 bp между никами, образованными транспозицией, тогда как R380 взаимодействует с нерасщепленной одноцепочечной ДНК транспозона, расположенной вне комплекса. Наконец, несмотря на свою консервативность и близость к сайту прикрепления, мутанты R188A и K290A не отменял целевую транспозицию. Наши результаты подтверждают функциональную важность этих остатков, участвующих в распознавании LTR и стабилизации STC, и указывают на возможные сайты для улучшения свойств транспозазы для целей инженерии генома.
Наконец, несмотря на свою консервативность и близость к сайту прикрепления, мутанты R188A и K290A не отменял целевую транспозицию. Наши результаты подтверждают функциональную важность этих остатков, участвующих в распознавании LTR и стабилизации STC, и указывают на возможные сайты для улучшения свойств транспозазы для целей инженерии генома.
a Транспозицию проводили путем трансформации бактерий плазмидой, содержащей сайт-мишень, показанный зеленым цветом, распознаваемым Cas12k:sgRNA (pTarget), плазмидой, содержащей донорную ДНК с последовательностями CAST RE и LE, показанными красным цветом ( pDonor) и плазмиду, содержащую кодирующие последовательности sgRNA, Cas12k, TnsC, TniQ и TnsB (pHelper). Интеграцию донорной последовательности в pTarget количественно определяли с помощью количественной ПЦР с использованием набора праймеров, амплифицирующих область pTarget, в которой не происходит транспозиции (PF 9). 0199-мишень и PR -мишень ) и набор праймеров, которые амплифицируют область между целевой и донорной последовательностями LE (продукт PF и продукт PR ). b Положение выбранных аминокислот в STC, подлежащих мутации и тестированию на транспозиционную активность. c Кратность изменения активности, измеренная с помощью количественной ПЦР для каждого мутанта TnsB. Для каждого мутанта проводили две или три биологические повторности. Отдельные точки данных, представляющие все технические повторы, обозначены точками. Столбцы представляют собой среднее значение кратности изменения активности, а усы, расположенные вокруг него, представляют собой стандартное отклонение. Активность дикого типа представлена пунктирной линией. Данные предоставляются в виде файла исходных данных.
0199-мишень и PR -мишень ) и набор праймеров, которые амплифицируют область между целевой и донорной последовательностями LE (продукт PF и продукт PR ). b Положение выбранных аминокислот в STC, подлежащих мутации и тестированию на транспозиционную активность. c Кратность изменения активности, измеренная с помощью количественной ПЦР для каждого мутанта TnsB. Для каждого мутанта проводили две или три биологические повторности. Отдельные точки данных, представляющие все технические повторы, обозначены точками. Столбцы представляют собой среднее значение кратности изменения активности, а усы, расположенные вокруг него, представляют собой стандартное отклонение. Активность дикого типа представлена пунктирной линией. Данные предоставляются в виде файла исходных данных.
Изображение в натуральную величину
Обсуждение
В прошлом году мы стали свидетелями значительного увеличения структурных знаний о системах CAST. Доступна структурная информация TnsC, TniQ и Cas12k типа V-K 32,33,34 , а также каскадного комплекса типа I-F, связанного с TniQ 35,36 . Однако, несмотря на эти достижения, нам необходимо точное понимание последовательности взаимодействий и промежуточных звеньев, ведущих к точной вставке ДНК-груза, чтобы решить возможную разработку систем CAST. Это отсутствие полного понимания того, как транспозиция осуществляется с помощью различных CAST, препятствует их повторному использованию для точной вставки ДНК в инструменты редактирования генов. Тип В-К мог представлять собой перспективную систему для развития этих средств за счет уменьшенного количества и размеров ее компонентов. Однако для этой цели необходимо решить проблему образования коинтегратов (рис. 1а).
Доступна структурная информация TnsC, TniQ и Cas12k типа V-K 32,33,34 , а также каскадного комплекса типа I-F, связанного с TniQ 35,36 . Однако, несмотря на эти достижения, нам необходимо точное понимание последовательности взаимодействий и промежуточных звеньев, ведущих к точной вставке ДНК-груза, чтобы решить возможную разработку систем CAST. Это отсутствие полного понимания того, как транспозиция осуществляется с помощью различных CAST, препятствует их повторному использованию для точной вставки ДНК в инструменты редактирования генов. Тип В-К мог представлять собой перспективную систему для развития этих средств за счет уменьшенного количества и размеров ее компонентов. Однако для этой цели необходимо решить проблему образования коинтегратов (рис. 1а).
Концевой комплекс транспозона shTnsB с низким разрешением (дополнительный рисунок 3) предполагает, что распознавание конца транспозона аналогично ecTnsB 18 ; однако высокая гетерогенность и гибкость сборки не позволили провести детальную молекулярную характеристику распознавания ДНК. Это согласуется с экспериментами в системе ecTn7, которые показали, что пре-транспозиционный комплекс менее стабилен, чем пост-транспозиционный комплекс, и что защита транспозонов меняется между пре- и посткаталитической стадиями 17,37 . Кроме того, эксперименты EMSA предполагают, что shTnsB может взаимодействовать с RE и LE в прекаталитическом состоянии в отсутствие ДНК-мишени (дополнительный рисунок 2). Таким образом, взаимодействие shTnsB с концами транспозона, по-видимому, не зависит от присутствия других компонентов системы CAST типа V-K. Более высокая стабильность посткаталитических комплексов привела нас к сборке shTnsB-STC, которую мы смогли определить с высоким разрешением. Этот комплекс представляет собой стадию после завершения реакции переэтерификации с ДНК-мишенью, обнаруживающую ее трехмерную сборку. Общая структура напоминает архитектуру транспозосомы 9 фага MuA.0127 22 . Тем не менее, можно наблюдать ключевые различия между сборками, особенно в домене NTD2 (рис.
Это согласуется с экспериментами в системе ecTn7, которые показали, что пре-транспозиционный комплекс менее стабилен, чем пост-транспозиционный комплекс, и что защита транспозонов меняется между пре- и посткаталитической стадиями 17,37 . Кроме того, эксперименты EMSA предполагают, что shTnsB может взаимодействовать с RE и LE в прекаталитическом состоянии в отсутствие ДНК-мишени (дополнительный рисунок 2). Таким образом, взаимодействие shTnsB с концами транспозона, по-видимому, не зависит от присутствия других компонентов системы CAST типа V-K. Более высокая стабильность посткаталитических комплексов привела нас к сборке shTnsB-STC, которую мы смогли определить с высоким разрешением. Этот комплекс представляет собой стадию после завершения реакции переэтерификации с ДНК-мишенью, обнаруживающую ее трехмерную сборку. Общая структура напоминает архитектуру транспозосомы 9 фага MuA.0127 22 . Тем не менее, можно наблюдать ключевые различия между сборками, особенно в домене NTD2 (рис. 6). Одно сходство между shTnsB и MuA, которое отличает их от системы Tn7, заключается в том, что типы V-K и Mu используют репликативную транспозицию, которая требует расщепления только одной цепи ДНК, в то время как Tn7 выполняет реакцию вырезания и вставки, включающую расщепление неперенесенной цепи TnsA. Следовательно, структурное сходство общего комплекса STC между shTnsB и MuA будет поддерживаться этими механистическими сходствами. Тем не менее, представляется затруднительным установить аналогии возможной комплексной сборки STC ecTnsB 9.0127 18 с использованием структуры shTnsB-STC, так как мы ожидаем, что ecTnsB-STC также должен включать ecTnsA 10 . То же самое может быть экстраполировано для CAST типов I-F и I-B, которые включают в свой состав TnsA.
6). Одно сходство между shTnsB и MuA, которое отличает их от системы Tn7, заключается в том, что типы V-K и Mu используют репликативную транспозицию, которая требует расщепления только одной цепи ДНК, в то время как Tn7 выполняет реакцию вырезания и вставки, включающую расщепление неперенесенной цепи TnsA. Следовательно, структурное сходство общего комплекса STC между shTnsB и MuA будет поддерживаться этими механистическими сходствами. Тем не менее, представляется затруднительным установить аналогии возможной комплексной сборки STC ecTnsB 9.0127 18 с использованием структуры shTnsB-STC, так как мы ожидаем, что ecTnsB-STC также должен включать ecTnsA 10 . То же самое может быть экстраполировано для CAST типов I-F и I-B, которые включают в свой состав TnsA.
Посткаталитическая структура shTnsB-STC выявила очень мало оснований-специфических контактов белок-ДНК (дополнительная рис. 7), как это также наблюдалось в прекаталитическом комплексе ecTnsB 18 . Домен NTD1 в shTnsB частично имеет такую же архитектуру, что и его аналоги в ecTnsB и MuA, в то время как NTD2 уникален в том смысле, что он имеет структурную гомологию с транскрипционным фактором Pax6 (рис. 5). N-концевая β-цепь, связывающая распознавание в одном из плеч транспозона с каталитическим центром на противоположной стороне и наоборот, является сингулярной особенностью shTnsB, еще предстоит определить, оказывает ли эта особенность некоторую аллостерическую регуляцию в каталитическом сайте DDE. . Две субъединицы shTnsB, участвующие в реакции, демонстрируют кислотную триаду в посткаталитическом состоянии. Атака 3′-ОН цепей транспозона на 5′ ДНК-мишени оставляет несвязанные основания (dT62 и dA63) в каждой цепи и молекулу воды, связанную с остатками аспарагиновой кислоты и остовом ДНК (дополнительная рис. 7) . Основываясь на структуре концевого комплекса shTnsB-STC и концевого комплекса транспозона ecTnsB, можно сделать вывод, что активный карман белков TnsB не подготовлен для катализа до связывания ДНК-мишени (рис.
Домен NTD1 в shTnsB частично имеет такую же архитектуру, что и его аналоги в ecTnsB и MuA, в то время как NTD2 уникален в том смысле, что он имеет структурную гомологию с транскрипционным фактором Pax6 (рис. 5). N-концевая β-цепь, связывающая распознавание в одном из плеч транспозона с каталитическим центром на противоположной стороне и наоборот, является сингулярной особенностью shTnsB, еще предстоит определить, оказывает ли эта особенность некоторую аллостерическую регуляцию в каталитическом сайте DDE. . Две субъединицы shTnsB, участвующие в реакции, демонстрируют кислотную триаду в посткаталитическом состоянии. Атака 3′-ОН цепей транспозона на 5′ ДНК-мишени оставляет несвязанные основания (dT62 и dA63) в каждой цепи и молекулу воды, связанную с остатками аспарагиновой кислоты и остовом ДНК (дополнительная рис. 7) . Основываясь на структуре концевого комплекса shTnsB-STC и концевого комплекса транспозона ecTnsB, можно сделать вывод, что активный карман белков TnsB не подготовлен для катализа до связывания ДНК-мишени (рис. 4d). Скорее всего, этот механизм сочетается с транс-сборкой STC, чтобы предотвратить неспецифическое расщепление.
4d). Скорее всего, этот механизм сочетается с транс-сборкой STC, чтобы предотвратить неспецифическое расщепление.
ShTnsB вставляет транспозон со смещением направленности 16 . Хотя концы LTR8-SR5 и LTR6-SR1 почти симметричны, длина и последовательности с правого и левого концов различаются (дополнительный рисунок 2f), что позволяет предположить, что эти различия в сочетании с необходимостью PAM для определения вставки сайте, может повлиять на направленность грузовой ДНК. Это мнение подтверждается наблюдением, что расстояние между PAM и местом прикрепления транспозона показывает очень узкое распределение 16 . Однако механизм, управляющий интеграцией ДНК-груза, до конца не ясен. Были предложены две альтернативные модели 32,34 . В обоих случаях сборка филамента shTnsC будет работать как молекулярная линейка, направляющая shTnsB к месту прикрепления. Действительно, С-концевая область shTnsB взаимодействует с shTnsC 32,34 , и взаимодействие shTnsB-shTnsC приводит к разборке филамента. Однако одна модель предполагает, что филамент shTnsC растет из shCas12k, а ассоциация головки филамента с shTniQ указывает на место вставки shTnsB и груз ДНК 32 . Вторая модель предполагает, что филамент shTnsC растет в противоположном направлении, и комплекс shCas12k-shTniQ останавливает рост, рекрутируя shTnsB с грузом ДНК, таким образом продолжая интеграцию 34 . Обе модели ставят дополнительные вопросы относительно взаимодействия shTnsB-shTnsC. Как показано в структуре shTnsB-STC, не все протомеры имеют одинаковую конформацию, и неясно, все ли протомеры shTnsB, каталитически активные или неактивные протомеры, взаимодействуют с shTnsC (рис. 1г, д), поскольку в обоих случаях C -конец в структуре не визуализируется. Однако, по-видимому, он топологически доступен для дополнительных взаимодействий. В свете современных биохимических и структурных данных 32,34 , мы хотели бы предложить альтернативную гипотетическую рабочую модель (рис. 8), которая считает, что shTnsC и shTnsB будут связаны до того, как shTnsC взаимодействует с ДНК, чтобы избежать неспецифических взаимодействий с геномом, которые могут быть токсичными для клетка.
Однако одна модель предполагает, что филамент shTnsC растет из shCas12k, а ассоциация головки филамента с shTniQ указывает на место вставки shTnsB и груз ДНК 32 . Вторая модель предполагает, что филамент shTnsC растет в противоположном направлении, и комплекс shCas12k-shTniQ останавливает рост, рекрутируя shTnsB с грузом ДНК, таким образом продолжая интеграцию 34 . Обе модели ставят дополнительные вопросы относительно взаимодействия shTnsB-shTnsC. Как показано в структуре shTnsB-STC, не все протомеры имеют одинаковую конформацию, и неясно, все ли протомеры shTnsB, каталитически активные или неактивные протомеры, взаимодействуют с shTnsC (рис. 1г, д), поскольку в обоих случаях C -конец в структуре не визуализируется. Однако, по-видимому, он топологически доступен для дополнительных взаимодействий. В свете современных биохимических и структурных данных 32,34 , мы хотели бы предложить альтернативную гипотетическую рабочую модель (рис. 8), которая считает, что shTnsC и shTnsB будут связаны до того, как shTnsC взаимодействует с ДНК, чтобы избежать неспецифических взаимодействий с геномом, которые могут быть токсичными для клетка. Таким образом, формирование филаментов shTnsC будет динамичным, так как присутствие shTnsB вызовет диссоциацию сборки в отсутствие shCas12k и shTniQ. В этом сценарии ассоциация shCas12k с ДНК-мишенью и shTniQ стабилизирует сборку комплексов shTnsC-shTsnB в месте вставки, а затем запускает интеграцию груза ДНК. Необходим дальнейший анализ ассоциации shTnsB-shTnsC, чтобы полностью понять интеграцию ДНК-груза в CAST типа V-K и подтвердить любую из этих рабочих моделей.
Таким образом, формирование филаментов shTnsC будет динамичным, так как присутствие shTnsB вызовет диссоциацию сборки в отсутствие shCas12k и shTniQ. В этом сценарии ассоциация shCas12k с ДНК-мишенью и shTniQ стабилизирует сборку комплексов shTnsC-shTsnB в месте вставки, а затем запускает интеграцию груза ДНК. Необходим дальнейший анализ ассоциации shTnsB-shTnsC, чтобы полностью понять интеграцию ДНК-груза в CAST типа V-K и подтвердить любую из этих рабочих моделей.
ShTnsC связывается с ДНК, образуя филаменты, которые деполимеризуются с помощью shTnsB (слева). Учитывая взаимодействия shTnsC с shTnsB и shCas12k-shTniQ, возникают две возможности (штриховые квадраты). Во-первых, shTnsC, связанный с shTnsB, может рекрутироваться с помощью нацеливающего комплекса, включающего shCas12k и shTniQ (верхний пунктирный квадрат). Во-вторых, shTnsC может сначала связываться с нацеливающим комплексом, а затем рекрутировать shTnsB (нижний пунктирный квадрат). Обе возможности продуцируют комплекс перед транспозицией, активирующий активность интегразы shTnsB и приводящий к вставке транспозона.
Обе возможности продуцируют комплекс перед транспозицией, активирующий активность интегразы shTnsB и приводящий к вставке транспозона.
Полноразмерное изображение
Отсутствие TnsA в типе V-K приводит к дополнительным вопросам, касающимся промежуточного разрешения интеграции, поскольку нерасщепленные 5′-концы транспозона приводят к продуктам коинтеграции транспозиции 15,16 . Транспозоны, полагающиеся на DDE-транспозазы, имеют разные механизмы для решения этой проблемы 26,38,39 . Например, Tn5053 содержит резольвазу TniR, которая использует сайты res , также присутствующие в транспозоне, для разрешения коинтеграта 40,41 , в то время как другие транспозазы генерируют шпильки для вырезания оставшейся ДНК 42 . Однако отсутствие домена вставки, который стабилизирует шпильку в каталитическом домене DDE shTnsB, не поддерживает эту возможность -16- для предотвращения коинтеграций. Кроме того, репликация ДНК и гомологичная рекомбинация могут разрешить коинтеграт в случае репликативной транспозиции 26 .
С другой стороны, наличие специфичной для хозяина резольвазы подтверждается тем фактом, что при транспозиции в E. coli , 20% продуктов внедрения являются коинтегратами 16 . Действительно, набор генов системы V-K (TnsB, TnsC и TniQ) аналогичен набору генов Tn5053, который содержит TniA, TniB (гомологи TnsB и TnsC) и TniQ 16 , и можно предположить, что резольваза не кодируется в Локус транспозона VK, но все еще присутствующий в естественном хозяине, может иметь ту же активность, что и резольваза TniR. Необходимо провести дальнейшие исследования на S. hofmannii или других родственных цианобактериях, прежде чем мы сможем полностью понять РНК-управляемую транспозицию в типе V-K. Решение этих вопросов является ключом к успешному созданию новых комплексов CAST, способных интегрировать большие ДНК-грузы в геномы эукариот.
Наша структура обеспечивает механистическое понимание того, как CAST shTnsB распознает последовательности ДНК RE и LE транспозона в STC. Структура также показывает конформационную гимнастику белка shTnsB для сборки с ДНК и дает подробное представление об активном центре после катализа. Полное выяснение механизмов сборки shTnsB с остальными компонентами CAST потребуется, чтобы использовать системы CAST для РНК-управляемой геномной инженерии.
Структура также показывает конформационную гимнастику белка shTnsB для сборки с ДНК и дает подробное представление об активном центре после катализа. Полное выяснение механизмов сборки shTnsB с остальными компонентами CAST потребуется, чтобы использовать системы CAST для РНК-управляемой геномной инженерии.
Методы
Получение и очистка белка
Кодирующая последовательность (IDT) Scytonema hofmannii (UTEX 2349) tnsB была клонирована с C -концевой гексагистидиновой (His)-меткой в вектор pET-21 (дополнительная таблица). Белки экспрессировали в клетках E. coli BL21 pRARE. культур E. coli выращивали при 37°C в среде Terrific Broth (TB) с 100 мг/л ампициллина до ОП 600 , равной 0,6. Сверхэкспрессию белков индуцировали 250 мМ ИПТГ в течение 16–18 ч при 18°С. Клетки собирали центрифугированием, мгновенно замораживали в жидком азоте и хранили при -80°С. Затем осадки ресуспендировали в лизирующем буфере (50 мМ HEPES pH 7,5, 500 мМ NaCl, 5 мМ MgCl 9). 0199 2 , 1 мМ TCEP, 1 таблетка полного коктейля ингибиторов без ЭДТА (Roche) на 50 мл, 50 ЕД/мл бензоназы, 2 мг на 50 мл лизоцима). Ресуспендированные осадки перемешивали в течение 1 ч при 4°С. Лизис завершали обработкой ультразвуком, а лизат центрифугировали при 10 000 × г в течение 45 минут для разделения растворимой и нерастворимой фракций. Растворимую фракцию загружали в 5 мл колонку HisTrap FF Crude (Cytiva), уравновешенную в буфере IMAC-A (50 мМ HEPES, pH 7,5, 500 мМ NaCl, 1 мМ TCEP, 10 мМ имидазол, 1 таблетка полного коктейля ингибиторов, не содержащего ЭДТА ( Roche) на 500 мл), а связанные белки элюировали ступенчатым повышением концентрации имидазола буфером IMAC-B (50 мМ HEPES pH 7,5, 500 мМ NaCl, 1 мМ TCEP, 500 мМ имидазол, 1 таблетка коктейля «Полный ингибитор»). без ЭДТА (Roche) на 500 мл). Обогащенные белковые фракции объединяли, а концентрацию NaCl снижали до 200 мМ с использованием буфера для разбавления (50 мМ HEPES, pH 7,5, 50 мМ NaCl, 1 мМ TCEP).
0199 2 , 1 мМ TCEP, 1 таблетка полного коктейля ингибиторов без ЭДТА (Roche) на 50 мл, 50 ЕД/мл бензоназы, 2 мг на 50 мл лизоцима). Ресуспендированные осадки перемешивали в течение 1 ч при 4°С. Лизис завершали обработкой ультразвуком, а лизат центрифугировали при 10 000 × г в течение 45 минут для разделения растворимой и нерастворимой фракций. Растворимую фракцию загружали в 5 мл колонку HisTrap FF Crude (Cytiva), уравновешенную в буфере IMAC-A (50 мМ HEPES, pH 7,5, 500 мМ NaCl, 1 мМ TCEP, 10 мМ имидазол, 1 таблетка полного коктейля ингибиторов, не содержащего ЭДТА ( Roche) на 500 мл), а связанные белки элюировали ступенчатым повышением концентрации имидазола буфером IMAC-B (50 мМ HEPES pH 7,5, 500 мМ NaCl, 1 мМ TCEP, 500 мМ имидазол, 1 таблетка коктейля «Полный ингибитор»). без ЭДТА (Roche) на 500 мл). Обогащенные белковые фракции объединяли, а концентрацию NaCl снижали до 200 мМ с использованием буфера для разбавления (50 мМ HEPES, pH 7,5, 50 мМ NaCl, 1 мМ TCEP). Образец наносили на колонку HiTrap Heparin HP (GE Healthcare), уравновешенную буфером Heparin-A (50 мМ HEPES, pH 7,5, 200 мМ NaCl, 1 мМ TCEP). Белок элюировали линейным градиентом 0-100% буфера Heparin-B (50 мМ HEPES pH 7,5, 1 мМ NaCl, 1 мМ TCEP). Фракции, содержащие белок, объединяли и смешивали с TEV-протеазой для расщепления гистидиновой метки. Затем белок концентрировали и дополнительно очищали с помощью эксклюзионной хроматографии (SEC) с использованием колонки HiLoad 16/600 Superdex 200 (Cytiva), уравновешенной буфером SEC (50 мМ HEPES, pH 7,5, 500 мМ NaCl, 1 мМ TCEP). Фракции, содержащие чистый белок, объединяли, концентрировали до 9мг/мл, мгновенно замороженные в жидком азоте и хранящиеся при температуре -80 °C.
Образец наносили на колонку HiTrap Heparin HP (GE Healthcare), уравновешенную буфером Heparin-A (50 мМ HEPES, pH 7,5, 200 мМ NaCl, 1 мМ TCEP). Белок элюировали линейным градиентом 0-100% буфера Heparin-B (50 мМ HEPES pH 7,5, 1 мМ NaCl, 1 мМ TCEP). Фракции, содержащие белок, объединяли и смешивали с TEV-протеазой для расщепления гистидиновой метки. Затем белок концентрировали и дополнительно очищали с помощью эксклюзионной хроматографии (SEC) с использованием колонки HiLoad 16/600 Superdex 200 (Cytiva), уравновешенной буфером SEC (50 мМ HEPES, pH 7,5, 500 мМ NaCl, 1 мМ TCEP). Фракции, содержащие чистый белок, объединяли, концентрировали до 9мг/мл, мгновенно замороженные в жидком азоте и хранящиеся при температуре -80 °C.
Производство ДНК
Последовательности ДНК, соответствующие отдельным повторам, двойным повторам и одноцепочечной одноцепочечной ДНК, были приобретены у IDT. Молекулы ДНК, содержащие три или более повторов, были получены с помощью ПЦР с донорной ДНК, клонированной в pUC57 (Genewiz) в качестве матрицы (дополнительная таблица 1). Последовательности ДНК были выбраны из природного транспозона для CAST типа V-K в S. hofmannii , описанном в 4,7,21 . Полную ДНК донора амплифицировали с использованием праймеров 5′-tgctacgtctctacgtgtacagtgactaat-3′ и 5′ ccacaaaaggcgtagtgtacagtgacaaat-3′, RE амплифицировали с использованием праймеров 5′-tgctacgtctctacgtgtacagtgactaat-3′ и 5′-atacaaaagcgacagtcaatttgtcattatgaaa -attatattgatgacatttaatttgtcatcaattaattaag-3′ и 5′-ccacaaaaggcgtagtgtacagtgacaaat-3′. Амплифицированные последовательности очищали с использованием набора QIAquick PCR Purification Kit (Qiagen) и элюировали водой, не содержащей нуклеаз.
Последовательности ДНК были выбраны из природного транспозона для CAST типа V-K в S. hofmannii , описанном в 4,7,21 . Полную ДНК донора амплифицировали с использованием праймеров 5′-tgctacgtctctacgtgtacagtgactaat-3′ и 5′ ccacaaaaggcgtagtgtacagtgacaaat-3′, RE амплифицировали с использованием праймеров 5′-tgctacgtctctacgtgtacagtgactaat-3′ и 5′-atacaaaagcgacagtcaatttgtcattatgaaa -attatattgatgacatttaatttgtcatcaattaattaag-3′ и 5′-ccacaaaaggcgtagtgtacagtgacaaat-3′. Амплифицированные последовательности очищали с использованием набора QIAquick PCR Purification Kit (Qiagen) и элюировали водой, не содержащей нуклеаз.
Анализ сдвига электромобильности (EMSA)
ДНК (донорскую, RE, LE или LTR(6)-SR(1)) смешивали с shTnsB в буфере, содержащем 50 мМ HEPES pH 7,5, 300 мМ NaCl, 5 мМ MgCl 2 и 1 мМ TCEP. Концентрации ДНК и shTnsB указаны на дополнительных рисунках 3c – e. Образцы инкубировали при 37 °C в течение 30 мин и загружали в гели для замедления ДНК 6% (Thermo Fisher Scientific). ДНК выявляли окрашиванием геля GelRed (VWR). Затем тот же гель окрашивали InstantBlue (Life Technologies) для обнаружения присутствия shTnsB и сравнения сдвигов полос.
ДНК выявляли окрашиванием геля GelRed (VWR). Затем тот же гель окрашивали InstantBlue (Life Technologies) для обнаружения присутствия shTnsB и сравнения сдвигов полос.
Крио-ЭМ пробоподготовка
Прекаталитический комплекс готовили с использованием 1 мкМ РЭ, 1 мкМ LE и 8 мкМ shTnsB в 300 мкл буфера, содержащего 50 мМ HEPES pH 7,5, 300 мМ NaCl, 5 мМ MgCl. 2 и 1 мМ TCEP. Образец инкубировали в течение 30 мин при 37°С и концентрировали до 50 мкл в фильтрах 10 кДа. Восстановление STC показано на дополнительном рисунке 4 и проводилось следующим образом. Перенесенные и неперенесенные нити (TS и NTS) из RE (олигонуклеотиды RE_Target и RE_polyA в дополнительной таблице 1) и LE (олигонуклеотиды LE_Target и LE_polyA в дополнительной таблице 1) смешивали по отдельности, инкубировали при 95 °C в течение 5 мин и оставили на льду на 10 мин. Впоследствии комплементарная одноцепочечная ДНК-мишень была добавлена к двухцепочечной ДНК TS-NTS из RE и LE (олигонуклеотиды Target_1 и Target_2 в дополнительной таблице 1 соответственно). ДцДНК TS-NTS из RE и LE инкубировали отдельно при 70 ° C в течение 5 минут и оставляли на льду на 10 минут. Затем их перемешивали и инкубировали при комнатной температуре в течение 10 мин. Наконец, 50 мМ HEPES pH 7,5, 300 мМ NaCl, 5 мМ MgCl 2 и 1 мМ TCEP добавляли к 10 мкМ ДНК STC ДНК перед добавлением 40 мкМ shTnsB. Образец инкубировали в течение 30 мин при 37°С.
ДцДНК TS-NTS из RE и LE инкубировали отдельно при 70 ° C в течение 5 минут и оставляли на льду на 10 минут. Затем их перемешивали и инкубировали при комнатной температуре в течение 10 мин. Наконец, 50 мМ HEPES pH 7,5, 300 мМ NaCl, 5 мМ MgCl 2 и 1 мМ TCEP добавляли к 10 мкМ ДНК STC ДНК перед добавлением 40 мкМ shTnsB. Образец инкубировали в течение 30 мин при 37°С.
Сетки для обоих образцов (прекаталитический комплекс и STC) были приготовлены путем нанесения 3 мкл свежеприготовленного комплекса (разведение 1:2) на сетки с отверстиями UltraAuFoil 300 меш R1,2/1,3 (Quantifoil), подвергнутые тлеющему разряду в течение 60 с при 10 мА (Leica EM ACE200) и глубокой заморозке в жидком этане (предварительно охлажденном жидким азотом) с использованием Vitrobot Mark IV (FEI, Thermo Fisher Scientific — время блоттинга 3 с, влажность 100%, 4 °C) .
Крио-ЭМ обработка данных
Сбор данных осуществлялся с помощью EPU 2.12.1 (ThermoFisher). Обработку данных проводили с помощью программы cryoSPARC версии 3. 3.2 23 . Выполняли коррекцию движения заплаты и оценку CTF заплаты. Частицы 9646 K были первоначально отобраны из 4574 микрофотографий с использованием устройства для сбора капель с минимальным и максимальным диаметром 50 и 200 Å соответственно, а затем извлечены и отсортированы с помощью двух раундов 2D-классификации. Выбранные 2D-классы содержали 415 K частиц, извлеченных с использованием блока размером 416 × 416 пикселей. Трехмерная реконструкция ab initio использовалась в качестве начального объема для неравномерного уточнения, а полученные частицы были проанализированы с помощью трехмерного анализа изменчивости 43 (дополнительный рисунок 5), который выявил непрерывную конформационную изменчивость дистальных концов ДНК и близлежащих доменов shTnsB (N-концевая часть и CTD цепей A и B). Два наиболее пространственно отличающихся полученных объема использовались в качестве эталонов для гетерогенного уточнения и были дополнительно уточнены с помощью неоднородного (NU) уточнения до глобального разрешения 2,47 Å (частицы 269 K) и 2,81 Å (частицы 155 K) на основе золотой стандарт корреляции оболочки Фурье (GSFSC) 0,143 критерий отсечки (дополнительный рисунок 6).
3.2 23 . Выполняли коррекцию движения заплаты и оценку CTF заплаты. Частицы 9646 K были первоначально отобраны из 4574 микрофотографий с использованием устройства для сбора капель с минимальным и максимальным диаметром 50 и 200 Å соответственно, а затем извлечены и отсортированы с помощью двух раундов 2D-классификации. Выбранные 2D-классы содержали 415 K частиц, извлеченных с использованием блока размером 416 × 416 пикселей. Трехмерная реконструкция ab initio использовалась в качестве начального объема для неравномерного уточнения, а полученные частицы были проанализированы с помощью трехмерного анализа изменчивости 43 (дополнительный рисунок 5), который выявил непрерывную конформационную изменчивость дистальных концов ДНК и близлежащих доменов shTnsB (N-концевая часть и CTD цепей A и B). Два наиболее пространственно отличающихся полученных объема использовались в качестве эталонов для гетерогенного уточнения и были дополнительно уточнены с помощью неоднородного (NU) уточнения до глобального разрешения 2,47 Å (частицы 269 K) и 2,81 Å (частицы 155 K) на основе золотой стандарт корреляции оболочки Фурье (GSFSC) 0,143 критерий отсечки (дополнительный рисунок 6). Параметры расфокусировки для каждой частицы и параметры CTF для каждой группы были уточнены во время уточнения NU. При визуальном осмотре плотность карты 2,47 Å оказалась значительно более непрерывной. Эта карта была дополнительно улучшена на дистальных концах с помощью еще одной итерации трехмерного анализа изменчивости частиц 43 и использование самых разных в пространственном отношении томов в качестве эталонов для еще одного раунда неоднородного уточнения. Большинство частиц попали в один класс (208 K), который был окончательно уточнен с помощью уточнения NU до карты 2,46 Å. Анализ 3DFSC показал сферичность 0,928 и диапазон углового разрешения 2,4–3,1 Å (дополнительный рисунок 6). Анализ локального разрешения был выполнен с помощью MonoRes 44 с использованием обертки cryoSPARC, который показал диапазон ~ 2–10 Å, при этом большая часть составляла около 2,5 Å, а дистальная часть — 4–8 Å. Построение модели выполнялось на картах, прошедших постобработку с помощью DeepEMhancer 0,13 45 .
Параметры расфокусировки для каждой частицы и параметры CTF для каждой группы были уточнены во время уточнения NU. При визуальном осмотре плотность карты 2,47 Å оказалась значительно более непрерывной. Эта карта была дополнительно улучшена на дистальных концах с помощью еще одной итерации трехмерного анализа изменчивости частиц 43 и использование самых разных в пространственном отношении томов в качестве эталонов для еще одного раунда неоднородного уточнения. Большинство частиц попали в один класс (208 K), который был окончательно уточнен с помощью уточнения NU до карты 2,46 Å. Анализ 3DFSC показал сферичность 0,928 и диапазон углового разрешения 2,4–3,1 Å (дополнительный рисунок 6). Анализ локального разрешения был выполнен с помощью MonoRes 44 с использованием обертки cryoSPARC, который показал диапазон ~ 2–10 Å, при этом большая часть составляла около 2,5 Å, а дистальная часть — 4–8 Å. Построение модели выполнялось на картах, прошедших постобработку с помощью DeepEMhancer 0,13 45 . В качестве входных данных использовались полукарты, в то время как нормализация и маскирование/шумоподавление входных объемов выполнялись автоматически в режиме tightTarget, что давало карты со значительно улучшенной интерпретируемостью. Окончательная модель, построенная на картах DeepEMhancer, была окончательно проверена с использованием экспериментальных карт.
В качестве входных данных использовались полукарты, в то время как нормализация и маскирование/шумоподавление входных объемов выполнялись автоматически в режиме tightTarget, что давало карты со значительно улучшенной интерпретируемостью. Окончательная модель, построенная на картах DeepEMhancer, была окончательно проверена с использованием экспериментальных карт.
Построение и уточнение атомной модели
Первоначальная модель была создана на основе структуры MuA (PDB: 4FCY) с использованием автоматизированного сервера моделирования гомологии белковой структуры SWISS-MODEL 46 . Это было твердое тело, встроенное в карту с помощью ChimeraX 47 . Подгонка модели была проверена и дополнительно подобрана в COOT 48 , а менее упорядоченные N- и C-концевые области были удалены. Модель Alphafold 49 мономера shTnsB была впоследствии использована для включения некоторых из этих областей в карту. Далее модель была перестроена de novo в COOT и уточнена с использованием phenix. real_space_refine 50 , а сервер гибкой настройки молекулярной динамики Namdinator использовался для ускорения и улучшения модели для сопоставления соответствия и для уточнения модели как на ранних, так и на поздних стадиях. этапы доработки 51 .
real_space_refine 50 , а сервер гибкой настройки молекулярной динамики Namdinator использовался для ускорения и улучшения модели для сопоставления соответствия и для уточнения модели как на ранних, так и на поздних стадиях. этапы доработки 51 .
Анализ транспозиции и мутагенез in vivo
Транспозиционную активность CAST определяли с использованием векторов pHelper, pTarget и pDonor, полученных от Addgene (кат. № 127922, 127926 и 127924). Мутанты shTnsB (рис. 7) были созданы в векторе pHelper с использованием набора для клонирования In-Fusion от Takara и праймеров, содержащих желаемые точечные мутации. Анализы in vivo проводили в соответствии с Saito et al. 52 . Вкратце, по 12 нг pHelper, pTarget и pDonor были преобразованы в 30 мкл TransforMax EC100 pir+ Electrocompetent 9.0135 E. coli (Люциген). Клетки восстанавливали в течение 1 ч и высевали на среду LB, содержащую ампициллин, канамицин и хлорамфеникол. Клетки соскребали через 24 часа после посева, лизировали в 15 мкл буфера для лизиса колоний (TE с 0,1% Triton X-100), кипятили в течение 5 минут, разбавляли 30 мкл воды и вращали при 4000× г в течение 10 минут для осаждения. обломки. Супернатант использовали для последующего анализа.
обломки. Супернатант использовали для последующего анализа.
Анализ активности кПЦР
Частоту вставок относительно концентрации целевой плазмиды определяли с помощью кПЦР (TaqMan Fast Advanced Master Mix, Applied Biosytems) с набором праймеров/зонда (5′-6-FAM, Int ZEN и набор праймеров/зондов (5′-6-FAM, Int ZEN, 3′-Iowa Black, IDT), соответствующих продукту транспозиции (прямой праймер: 5′-ggttgagaagtcatttaataaggccactgttaaacg-3′, обратный праймер: 5′-aacgctgatgggtcacgacg- 3′, зонд: 5′-ctgtcgtcggtgacagattaatgtcattgtgac-3′) (рис. 7). Каждая реакция (11 мкл) содержала 2 мкл экстрагированных нуклеиновых кислот, 900 нМ прямого праймера, 900 нМ обратного праймера и 250 нМ зонда. Флуоресценцию измеряли с использованием прибора LightCycler 480 (Roche). Данные анализировали методом 2 –∆∆Ct с нормализацией по pTarget Ct.
Сводка отчета
Дополнительную информацию о дизайне исследования можно найти в Сводке отчета об исследовании природы, связанной с этой статьей.
Доступность данных
Реагенты, полученные в ходе этого исследования, доступны по запросу с заполненным Соглашением о передаче материалов. Атомные координаты и крио-ЭМ карты, включенные в это исследование, были депонированы в банке данных белков и банке данных электронной микроскопии под кодами доступа: PDB 8AA5, EMD-1529.4 и EMD-15344. Исходные данные qPCR и несрезанные гели предоставляются с этой статьей. Исходные данные приводятся вместе с настоящей статьей.
Список литературы
Макарова К.С. и др. Эволюционная классификация систем CRISPR-Cas: взрыв класса 2 и производные варианты. Нац. Преподобный Микробиолог. 18 , 67–83 (2020).
Артикул КАС пабмед Google Scholar
Дудна, Дж. А. Перспективы и проблемы терапевтического редактирования генома. Природа 578 , 229–236 (2020).

Артикул ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Фор, Г. и др. CRISPR-Cas в мобильных генетических элементах: контрзащита и не только. Нац. Преподобный Микробиолог. 17 , 513–525 (2019).
Артикул КАС пабмед Google Scholar
Петерс Дж. Э., Макарова К. С., Шмаков С., Кунин Е. В. Рекрутирование систем CRISPR-Cas Tn7-подобными транспозонами. Проц. Натл акад. науч. США 114 , E7358–E7366 (2017).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Кунин Е. В., Макарова К. С. Происхождение и эволюция систем CRISPR-Cas. Филос. Транс. Р. Соц. Лонд. Б биол. науч. 374 , 20180087 (2019).
Артикул КАС пабмед ПабМед Центральный Google Scholar
«>Шмаков С. и др. Разнообразие и эволюция систем CRISPR-Cas класса 2. Нац. Преподобный Микробиолог. 15 , 169–182 (2017).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Klompe, S.E., Vo, PLH, Halpin-Healy, T.S. & Sternberg, S.H. Системы CRISPR-Cas, кодируемые транспозонами, обеспечивают прямую интеграцию ДНК под управлением РНК. Природа 571 , 219–225 (2019).
Hickman, A.B. et al. Неожиданное структурное разнообразие в рекомбинации ДНК: рестрикционная эндонуклеазная связь. Мол. Cell 5 , 1025–1034 (2000).
Артикул КАС пабмед Google Scholar
«>Stellwagen, AE & Craig, NL. Анализ мутантов с усилением функции АТФ-зависимого регулятора транспозиции Tn7. Дж. Мол. биол. 305 , 633–642 (2001).
Артикул КАС пабмед Google Scholar
Сарновский Р. Дж., Мэй Э. У. и Крейг Н. Л. Транспозаза Tn7 представляет собой гетеромерный комплекс, в котором активность разрыва и соединения ДНК распределена между различными генными продуктами. EMBO J. 15 , 6348–6361 (1996).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Питерс, Дж. Э. Tn7. Микробиолог. Спектр.
 2 , 1–20 (2014).
2 , 1–20 (2014).Кудувалли, П. Н., Рао, Дж. Э. и Крейг, Н. Л. Структура ДНК-мишени играет решающую роль в транспозиции Tn7. EMBO J. 20 , 924–932 (2001).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Райс, П. А., Крейг, Н. Л. и Дайда, Ф. Комментарий к «Вставка ДНК под управлением РНК с CRISPR-ассоциированными транспозазами». Наука , https://doi.org/10.1126/science.abb2022 (2020).
Стрекер, Дж., Ладха, А., Макарова, К.С., Кунин, Е.В. и Чжан, Ф. Ответ на комментарий к «РНК-управляемая вставка ДНК с CRISPR-ассоциированными транспозазами». Наука , https://doi.org/10.1126/science.abb2920 (2020).
Холдер, Дж. В. и Крейг, Н. Л. Архитектура посттранспозиционного комплекса Tn7: сложная нуклеопротеиновая структура. Дж. Мол. биол.
 401 , 167–181 (2010).
401 , 167–181 (2010).Артикул КАС пабмед ПабМед Центральный Google Scholar
Качмарска З. и др. Структурная основа распознавания концов транспозонов объясняет центральные особенности систем транспозиции Tn7. Мол. Сотовый , https://doi.org/10.1016/j.molcel.2022.05.005 (2022).
Дэвис Д. Р., Горышин И. Ю., Резникофф В. С. и Реймент И. Трехмерная структура промежуточного соединения транспозиции синаптического комплекса Tn5. Наука 289 , 77–85 (2000).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед Google Scholar
Ghanim, G.E., Kellogg, E.H., Nogales, E. & Rio, D.C. Структура комплекса транспозаза-ДНК P-элемента выявляет необычные структуры ДНК и контакты GTP-ДНК. Нац. Структура Мол. биол. 26 , 1013–1022 (2019).
Артикул КАС пабмед ПабМед Центральный Google Scholar
«>Montaño, S.P., Pigli, Y.Z. & Rice, P.A. Структура транспозосом μ проливает свет на эволюцию рекомбиназы DDE. Природа 491 , 413–417 (2012).
Артикул ОБЪЯВЛЕНИЯ пабмед ПабМед Центральный Google Scholar
Пуджани, А., Рубинштейн, Дж. Л., Флит, Д. Дж. и Брубейкер, М. А. cryoSPARC: алгоритмы для быстрого неконтролируемого определения структуры крио-ЭМ. Нац. Методы 14 , 290–296 (2017).
Артикул КАС пабмед Google Scholar
Маннервик, М. Гены-мишени гомеодоменовых белков. Bioessays 21 , 267–270 (1999).

Артикул КАС пабмед Google Scholar
Хикман, А. Б. и Дайда, Ф. Механизмы транспозиции ДНК. Микробиологический спектр. 3 , 0034–2014 (2015). МДНА3-.
Артикул Google Scholar
Siguier, P., Gourbeyre, E. & Chandler, M. Известные известные, известные неизвестные и неизвестные неизвестные в прокариотической транспозиции. Курс. мнение микробиол. 38 , 171–180 (2017).
Артикул КАС пабмед Google Scholar
Allingham, J. S., Pribil, P. A. & Haniford, D. B. Все три остатка каталитической триады транспозазы Tn 10 DDE функционируют в связывании ионов двухвалентных металлов. Дж. Мол. биол. 289 , 1195–1206 (1999).
Артикул КАС пабмед Google Scholar
«>Холм, Л. и Лааксо, Л. М. Обновление сервера Дали. Рез. нуклеиновых кислот . 44 , W351–W355 (2016 г.).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Xu, H. E. et al. Кристаллическая структура комплекса парный домен Pax6 человека и ДНК показывает специфическую роль линкерной области и карбоксиконцевого субдомена в связывании ДНК. Гены Дев. 13 , 1263–1275 (1999).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Benler, S.
 et al. Гены-карго Tn7-подобных транспозонов включают огромное разнообразие защитных систем, мобильных генетических элементов и генов устойчивости к антибиотикам. mBio 12 , e0293821 (2021).
et al. Гены-карго Tn7-подобных транспозонов включают огромное разнообразие защитных систем, мобильных генетических элементов и генов устойчивости к антибиотикам. mBio 12 , e0293821 (2021).Артикул пабмед Google Scholar
Querques, I., Schmitz, M., Oberli, S., Chanez, C. & Jinek, M. Выбор и ремоделирование целевых участков с помощью систем CRISPR-транспозонов типа V. Природа 599 , 497–502 (2021).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Xiao, R. et al. Структурные основы распознавания ДНК-мишени с помощью CRISPR-Cas12k для РНК-управляемой транспозиции ДНК. Мол. Сотовый 81 , 4457–4466.e4455 (2021 г.).
Артикул КАС пабмед Google Scholar
«>Халпин-Хили, Т.С., Кломпе, С.Е., Штернберг, С.Х. и Фернандес, И.С. Структурная основа нацеливания ДНК с помощью системы CRISPR-Cas, кодируемой транспозоном. Природа 577 , 271–274 (2020).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед Google Scholar
Цзя, Н., Се, В., де ла Круз, М. Дж., Энг, Э. Т. и Патель, Д. Дж. Структурно-функциональное понимание начального этапа интеграции ДНК с помощью комплекса CRISPR-Cas-Transposon. Сотовые Res. 30 , 182–184 (2020).
Артикул КАС пабмед ПабМед Центральный Google Scholar
«>Холодий Г.Ю. и др. Четыре гена, два конца и res-область участвуют в транспозиции Tn5053: парадигма нового семейства транспозонов, несущих либо мероперон, либо интегрон. Мол. микробиол. 17 , 1189 (1995).
Артикул КАС пабмед Google Scholar
Николас Э. и др. Семейство репликативных транспозонов Tn3. Микробиолог. Спектр. 3 , 0060–2014 (2014). МДНК3.
Google Scholar
Петровски С. и Станисич В. А. Tn502 и Tn512 являются охотниками за res-сайтами, что свидетельствует о независимой от резольвазы транспозиции в случайные сайты.
 J. Бактериол. 192 , 1865–1874 (2010).
J. Бактериол. 192 , 1865–1874 (2010).Артикул КАС пабмед ПабМед Центральный Google Scholar
Минахина С., Холодий Г., Миндлин С., Юрьева О., Никифоров В. Транспозоны семейства Tn5053 являются охотниками за рез-сайтами, распознающими рез-сайты плазмид, занятые родственными резольвазами. Мол. микробиол. 33 , 1059 (1999).
Артикул КАС пабмед Google Scholar
Chen, Q. et al. Структурная основа бесшовного вырезания и специфического нацеливания транспозазой piggyBac. Нац. коммун. 11 , 3446 (2020).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Пунджани, А. и Флит, Д. Дж. Трехмерный анализ изменчивости: выявление непрерывной гибкости и дискретной неоднородности крио-ЭМ с одной частицей.
 Дж. Структура. биол. 213 , 107702 (2021).
Дж. Структура. биол. 213 , 107702 (2021).Артикул КАС пабмед Google Scholar
Вилас, Дж. Л. и др. MonoRes: автоматическая и точная оценка локального разрешения для карт электронной микроскопии. Структура 26 , 337–344.e334 (2018).
Артикул КАС пабмед Google Scholar
Санчес-Гарсия, Р. и др. DeepEMhancer: решение для глубокого обучения для крио-ЭМ объемной постобработки. Комм. биол. 4 , 874 (2021).
Артикул пабмед ПабМед Центральный Google Scholar
Bienert, S. et al. Репозиторий SWISS-MODEL — новые возможности и функциональность. Рез. нуклеиновых кислот. 45 , Д313–д319 (2017).
Артикул КАС пабмед Google Scholar
«>Эмсли П., Локамп Б., Скотт В. Г. и Коутан К. Особенности и развитие Coot. Acta Кристаллогр. Д. биол. Кристаллогр. 66 , 486–501 (2010).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Бэк, М. и др. Точное предсказание белковых структур и взаимодействий с использованием трехдорожечной нейронной сети. Наука 373 , 871–876 (2021).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Адамс, П. Д. и др. PHENIX: комплексная система на основе Python для решения макромолекулярной структуры.
 Acta Кристаллогр. Д. биол. Кристаллогр. 66 , 213–221 (2010).
Acta Кристаллогр. Д. биол. Кристаллогр. 66 , 213–221 (2010).Артикул КАС пабмед ПабМед Центральный Google Scholar
Kidmose, R. T. et al. Namdinator — автоматическая молекулярно-динамическая гибкая подгонка структурных моделей к крио-ЭМ и кристаллографическим экспериментальным картам. IUCrJ 6 , 526–531 (2019).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Сайто, М. и др. Двойной режим CRISPR-ассоциированного самонаведения транспозонов. Cell 184 , 2441–2453.e2418 (2021).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Рыбарски Дж. Р., Ху К., Хилл А. М., Уилке К. О. и Финкельштейн И. Дж. Метагеномное открытие CRISPR-ассоциированных транспозонов. Проц. Натл акад. науч. США , https://doi.org/10.1073/pnas.2112279118 (2021).
Чой, К.Ю., Ли, Ю., Сарновский, Р. и Крейг, Н.Л. Прямое взаимодействие между субъединицами TnsA и TnsB контролирует гетеромерную транспозазу Tn7. Проц. Натл акад. науч. США 110 , E2038–E2045 (2013 г.).
Strecker, J. et al. Вставка ДНК под управлением РНК с CRISPR-ассоциированными транспозазами. Наука 364 , 48–53 (2019).
Артикул ОБЪЯВЛЕНИЯ Google Scholar
Peterson, G. & Reznikoff, W. Мутации активного сайта транспозазы Tn5 указывают на положение донорской основной ДНК в синаптическом комплексе. Дж. Биол. хим. 278 , 1904–1909 (2003).
Артикул КАС пабмед Google Scholar
Park, J. U. et al. Структурная основа для выбора сайта-мишени в системах транспозиции ДНК, управляемых РНК. Наука 373 , 768–774 (2021).
Артикул ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Google Scholar
Skelding, Z., Queen-Baker, J. & Craig, N.L. Альтернативные взаимодействия между транспозазой Tn7 и белком, связывающим ДНК-мишень Tn7, регулируют иммунитет и транспозицию мишени. EMBO J. 22 , 5904–5917 (2003).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Goddard, T.D. et al. UCSF ChimeraX: решение современных задач визуализации и анализа. Науки о белках. 27 , 14–25 (2018).
Артикул КАС пабмед Google Scholar
Скачать ссылки
Благодарности
Мы благодарим Датский национальный центр крио-ЭМ в CFIM в Копенгагенском университете и особенно Тиллманн Пейп за поддержку во время сбора крио-ЭМ данных. Мы также благодарим отдел экспрессии белков CPR за помощь в экспрессии и очистке белков. ФТК является участником Копенгагенской программы докторантуры по биологическим наукам (NNF19SA0035440). Г.М. является частью Центра белковых исследований (CPR) Фонда Ново Нордиск, который финансируется Фондом Ново Нордиск (грант NNF14CC0001). Эта работа также была поддержана грантом NNF0024386, грантом NNF17SA0030214 и грантами Distinguished Investigator (NNF18OC0055061) для GM, который является членом Кластера интегративной структурной биологии (ISBUC) в Копенгагенском университете.
Мы также благодарим отдел экспрессии белков CPR за помощь в экспрессии и очистке белков. ФТК является участником Копенгагенской программы докторантуры по биологическим наукам (NNF19SA0035440). Г.М. является частью Центра белковых исследований (CPR) Фонда Ново Нордиск, который финансируется Фондом Ново Нордиск (грант NNF14CC0001). Эта работа также была поддержана грантом NNF0024386, грантом NNF17SA0030214 и грантами Distinguished Investigator (NNF18OC0055061) для GM, который является членом Кластера интегративной структурной биологии (ISBUC) в Копенгагенском университете.
Информация об авторе
Примечания автора
Стефано Стелла
Текущий адрес: Twelve Bio ApS, Ole Maaløes Vej 3, 2200, Копенгаген, Дания
Авторы и филиалы
Группа структурной молекулярной биологии, Фонд Ново Нордиск, Центр белковых исследований, Университет здравоохранения и наук of Copenhagen, 2200, Копенгаген, Дания
Франциско Тенхо-Кастаньо, Николас Софос, Луиза С.
 Штуцке, Андерс Фульсанг, Стефано Стелла и Гильермо Монтойя
Штуцке, Андерс Фульсанг, Стефано Стелла и Гильермо МонтойяОтделение по очистке и характеристике белков, Исследовательский центр Ново Нордиск, Факультет Копенгагенского университета здоровья и медицинских наук, 2200, Копенгаген, Дания
Blanca López-Méndez
Авторы
- Francisco Tenjo-Castaño
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Николас Софос
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Blanca López-Méndez
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Luisa S. Stutzke
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Anders Fuglsang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Stefano Stella
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Guillermo Montoya
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
G. M. задумал исследование, F.T.C. и Г.М. поставил биохимические эксперименты. ФТК и С.С. установили протокол экспрессии и очистки. ФТК и AF охарактеризовали свойства связывания белок-ДНК. ФТК и Л.С. создали мутантов и провели эксперименты по транспозиции. ФТК и Б.Л.М. выполнил анализ SEC-MALS, F.T.C. подготовили сетки ЭМ и собрали крио-ЭМ изображения с Н.С. ФТК и Н.С. выполнил крио-ЭМ обработку данных, построил модели и Г.М. приступил к крио-ЭМ карте и анализу структуры с их помощью. Общие результаты обсуждались и оценивались со всеми авторами. Г.М. координировал и руководил проектом и написал рукопись с участием всех авторов.
M. задумал исследование, F.T.C. и Г.М. поставил биохимические эксперименты. ФТК и С.С. установили протокол экспрессии и очистки. ФТК и AF охарактеризовали свойства связывания белок-ДНК. ФТК и Л.С. создали мутантов и провели эксперименты по транспозиции. ФТК и Б.Л.М. выполнил анализ SEC-MALS, F.T.C. подготовили сетки ЭМ и собрали крио-ЭМ изображения с Н.С. ФТК и Н.С. выполнил крио-ЭМ обработку данных, построил модели и Г.М. приступил к крио-ЭМ карте и анализу структуры с их помощью. Общие результаты обсуждались и оценивались со всеми авторами. Г.М. координировал и руководил проектом и написал рукопись с участием всех авторов.
Автор, ответственный за переписку
Переписка с Гильермо Монтойя.
Декларации этики
Конкурирующие интересы
G.M. и S.S. являются соучредителями и членами Twelve Bio BoD. Остальные авторы заявляют об отсутствии конкурирующих интересов.
Рецензирование
Информация о рецензировании
Nature Communications благодарит анонимных рецензентов за их вклад в рецензирование этой работы. Доступны отчеты рецензентов.
Доступны отчеты рецензентов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Supplementary information
Supplementary Information
Peer Review File
Description of Additional Supplementary Files
Supplementary Movie 1
Reporting Summary
Исходные данные
Исходные данные
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате. , при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатки и разрешения
Об этой статье
10 крупнейших конкурентов Facebook
Всякий раз, когда мы думаем провести некоторое время в социальных сетях, одно имя, которое обязательно приходит нам на ум, это Facebook.
Социальная сеть №1 с более чем 2 миллиардами активных пользователей, Facebook теперь почти синоним социальных сетей. Он предлагает такие функции, как обмен мгновенными сообщениями, обмен фотографиями, лента новостей, группы, торговая площадка, обмен видео и т. д., и владеет почти большинством из 5 ведущих социальных сетей, включая Instagram и WhatsApp.
д., и владеет почти большинством из 5 ведущих социальных сетей, включая Instagram и WhatsApp.
С момента своего основания компания известна своей уникальной моделью доходов, в которой большая часть доходов поступает от целевой рекламы. По данным за 2017 год, выручка компании составила 40 миллиардов долларов.
С ростом популярности у него также появились сильные конкуренты. Вот несколько имен, которые могут составить гиганту жесткую конкуренцию с точки зрения доходов и популярности.
Рекламные конкуренты Facebook
По данным eMarketer, три гиганта – Amazon, Google и Facebook вместе занимают 70% всех потраченных долларов на цифровую рекламу.
Google является крупнейшим конкурентом Facebook, когда речь идет о рекламе. Вместе компании известны как цифровая дуополия за доминирование на рекламной платформе.
Согласно отчету за 2018 год, Google занимает 40%, а Facebook — 22,7% доли доходов от рекламы в Великобритании.
Источник: medium. com
comБольшая часть дохода Google приходится на рекламу. Чтобы уравновесить Google AdWords, Facebook запустил пакеты продвижения социальных сетей для своих страниц. Тем не менее, большая часть расходов на электронную коммерцию приходится на Google из-за его популярности.
Помимо рекламы, Google также представил Orkut, Google+, Hangouts, Allo, Hello и т. д., чтобы конкурировать с Facebook и его дочерними компаниями, когда речь заходит о платформах социальных сетей. Несмотря на то, что большинство из них потерпели неудачу, Google по-прежнему остается одним из крупнейших конкурентов Facebook.
Google против Facebook
И Google, и Facebook занимают первые места, когда мы говорим о монетизации данных или целевой рекламе.
В основном два гиганта соревнуются на рекламной платформе. Google управляет AdWords, рекламной платформой на основе аукциона, которая позволяет рекламодателям размещать рекламу в результатах поиска Google и в партнерских объявлениях. Facebook, с другой стороны, управляет Facebook Ads, программной рекламной платформой, которая позволяет рекламодателям покупать места на Facebook и на партнерских сайтах.
Когда мы говорим о доходах, Google значительно превосходит Facebook. По данным Statistic.com, выручка Google в 2021 году составила 209 миллиардов долларов, а Facebook — 114 миллиардов долларов.
Amazon
После Google Amazon можно считать еще одним серьезным конкурентом Facebook в мире рекламы. Хотя Amazon в настоящее время занимает 8,8% доли рекламы, прогнозируется, что в следующем году этот процент увеличится на 10%.
Доля рекламы Facebook и AmazonРынок Facebook вырос на 0,3%, в то время как Amazon увеличился на 2% за год. Из-за этого шокирующего роста Facebook включил Amazon в список конкурентов по рекламе.
Facebook против Amazon
Amazon сильно отличается от Facebook, когда мы говорим об операционной модели. В то время как Facebook является платформой социальной сети, Amazon в основном является сайтом электронной коммерции.
Чтобы закрепиться на платформе электронной коммерции, которая может оказаться полезной для увеличения доли рекламы, Facebook представил Facebook Marketplace. Но есть несколько различий между двумя сайтами электронной коммерции. В Amazon продукты рекламируются с использованием спонсируемых продуктов Amazon, и платить нужно только при нажатии на рекламу. Более того, Amazon берет на себя полную ответственность за доставку продукта, за который они взимают плату за доставку.
Но есть несколько различий между двумя сайтами электронной коммерции. В Amazon продукты рекламируются с использованием спонсируемых продуктов Amazon, и платить нужно только при нажатии на рекламу. Более того, Amazon берет на себя полную ответственность за доставку продукта, за который они взимают плату за доставку.
Но на Facebook продавец должен размещать рекламу, продвигать ее и измерять рентабельность инвестиций. Более того, продавец на Facebook должен самостоятельно позаботиться о доставке и доставке, не добавляя дополнительных расходов на доставку.
Впрочем, если говорить о доходной модели, то сходства много. Facebook Watch конкурирует с Amazon Prime. Кроме того, Facebook конкурирует с Amazon, когда дело доходит до привлечения розничных продавцов и продавцов электронной коммерции для размещения рекламы на платформе.
Конкуренты Facebook по пользовательской базе
Facebook — не единственный веб-сайт, когда речь идет о социальных сетях. Он делится своей пользовательской базой со следующими конкурентами.
TikTok
TikTok был запущен в 2017 году, но всего за год его пользовательская база выросла на 700 миллионов благодаря крупным инвестициям в маркетинг влияния. Мало того, TikTok использует уникальную стратегию, чтобы выйти на конкуренцию. Он купил Musical.ly в 2017 году. С 2018 года он начал переманивать бывших сотрудников Facebook с зарплатой на 20% выше, чем у Facebook.
Сегодня TikTok — один из крупнейших конкурентов Facebook. Фактически, у него более 1,2 миллиарда активных пользователей в месяц, и его пользовательская база растет с каждым днем.
Facebook, чтобы решить эту проблему, запустил Reels в Instagram и на собственной платформе. Но компания по-прежнему уступает TikTok по пользовательской базе.
Facebook против TikTok
Если говорить о статистике, то TikTok, безусловно, доминирует над Facebook, когда речь идет о поколении Z в качестве целевой аудитории (41% пользователей TikTok в возрасте от 16 до 24 лет). Он, безусловно, понимал привычки и предпочтения этой возрастной группы лучше, чем Facebook.
В результате?
TikTok превзошел Facebook, когда дело доходит до привлечения большего внимания на пользователя. В среднем пользователь проводит всего 43 минуты в Facebook и 52 минуты в день в TikTok.
Кроме того-
TikTok приобрел огромную популярность в области создания видео благодаря своим мощным инструментам для работы с камерой — Pride, Face Filters 3D Mask, AR. По сравнению с этим функции Facebook ограничены, и пользователям часто приходится прибегать к другим приложениям для редактирования, чтобы получить лучшее от Reels. Однако с введением шаблонов Reels платформа стала более простой в использовании.
Более того, представители поколения Z предпочитают алгоритм TikTok алгоритму Facebook. Им не нравится алгоритм Facebook, который показывает сообщения их друзей в хронологическом порядке. С другой стороны, алгоритм TikTok гораздо более персонализирован.
Честно говоря, Facebook пытается улучшить свои алгоритмы. Но ему все еще нужно догнать TikTok.
Twitter тоже конкурирует с Facebook, когда речь идет о пользователях и их вовлеченности.
По оценке на июль 2019 года, Facebook по-прежнему лидирует с 2,38 млрд активных пользователей в месяц, а Twitter занимает 12-е место в рейтинге.0127-й с 330 миллионами пользователей.
Несмотря на то, что разница между пользователями огромна, Facebook сталкивается с жесткой конкуренцией, потому что Twitter набирает популярность для передачи сообщений в прямом эфире среди миллениалов.
Facebook против Twitter
Если сравнивать функции и цели, Twitter сильно отличается от Facebook.
Facebook объединяет людей, где можно написать сообщение неограниченного количества символов. Пользователи могут заводить «друзей», лайкать и делиться публикацией по своему выбору, которая остается вечнозеленой. Даже они могут мгновенно отправлять сообщения и играть в игры на Facebook.
Пока Твиттер объединяет идеи и интересы. Пользователи могут «следовать» за другими, могут находить последние трендовые новости. Они могут твитить и ретвитить свой ответ, но он ограничен только 280 символами. Но из-за постоянного взаимодействия в реальном времени содержимое имеет короткий срок службы.
Они могут твитить и ретвитить свой ответ, но он ограничен только 280 символами. Но из-за постоянного взаимодействия в реальном времени содержимое имеет короткий срок службы.
Но модель доходов Facebook очень похожа на модель Twitter, и обе компании конкурируют за то, чтобы привлечь как можно больше внимания пользователей и как можно больше рекламы.
Считается самой быстрорастущей платформой в истории, которая достигла 10 миллионов новых посетителей за месяц. В августе 2019 г., ежемесячная аудитория Pinterest достигла 291 миллиона активных пользователей, и никто не может оглядываться назад, учитывая, что никто не может справиться с этой прорывной бизнес-моделью.
Кроме того, Pinterest привлекает огромное количество реферального трафика на бизнес-сайты. Таким образом, глобальные маркетологи предпочитают его для различных маркетинговых целей, что делает его одним из конкурентов Facebook.
Pinterest против Facebook
Facebook и Pinterest отличаются своей операционной моделью. В то время как Facebook стремится стать универсальной платформой социальной сети, где люди могут общаться и общаться, Pinterest делает упор на упрощение поиска, сохранения и обмена информацией с помощью фотографий, видео и ссылок.
В то время как Facebook стремится стать универсальной платформой социальной сети, где люди могут общаться и общаться, Pinterest делает упор на упрощение поиска, сохранения и обмена информацией с помощью фотографий, видео и ссылок.
Пользователи Facebook могут создавать небольшие группы друзей с общими интересами, могут общаться и делиться с ними информацией. Но Pinterest не поддерживает группы. Только пользователь может подписываться на других пользователей и видеть их булавки в собственной ленте новостей.
Snapchat
Snapchat является крупным конкурентом Facebook и его дочерних компаний, таких как Messenger и Instagram, когда дело доходит до обмена мгновенными сообщениями и обмена фотографиями и видео. Он считается одной из самых быстрорастущих социальных платформ с более чем 203 миллионами активных пользователей в день (2019 г.). Это приложение, как и Tik Tok, более популярно среди поколения Z (нынешние подростки).
Приблизительное количество видео, просматриваемых и распространяемых ежедневно на платформе, составляет 10 миллиардов.
Snapchat против Facebook
Дебаты между Snapchat и Facebook продолжаются с тех пор, как Snapchat отказалась от приобретения FB. С тех пор Facebook удалось скопировать большинство функций из исходного приложения и добавить функции историй, мгновенных фото-сообщений и т. д. в Instagram, Messenger и WhatsApp, сделав их бизнес-модели похожими на бизнес-модель Snapchat.
LinkedIn имеет огромную базу пользователей из более чем 645 миллионов пользователей со всего мира, что делает его одной из самых популярных платформ для найма работодателей или поиска работы. Он конкурирует с Facebook по популярности среди профессионалов.
LinkedIn и Facebook
LinkedIn и Facebook очень сильно отличаются друг от друга. Первая представляет собой бизнес-платформу, которая предлагает профили и сети для взаимодействия между профессионалами, а вторая помогает общаться с «друзьями». Но оба конкурируют друг с другом, когда речь идет о привлечении наибольшего внимания пользователей и получении большей части рекламы от рекламодателей.
Более того, с запуском Jobs на Facebook Facebook сделал LinkedIn своим прямым конкурентом.
Конкуренты Facebook в индустрии обмена видео
Facebook не ограничивается обычными сайтами социальных сетей. Компания со своим предложением Facebook Watch является известным претендентом на хостинг видео и обмен видео и активно конкурирует с такими гигантами, как YouTube, Prime и т. д.
YouTube
YouTube конкурирует с Facebook за обмен видео. Он считается второй по величине поисковой системой после Google, а количество активных пользователей в настоящее время составляет 2 миллиарда, что делает приложение одним из самых серьезных конкурентов Facebook.
Чтобы конкурировать с YouTube, Facebook запустил Facebook Watch в 2017 году, который в настоящее время посещает 720 миллионов пользователей в месяц.
Facebook против YouTube
Хотя обе платформы позволяют обмениваться видео, они сильно отличаются друг от друга с точки зрения функционирования.
YouTube предлагает более длительный срок хранения видео, чем Watch. Платформа Google использует функции ранжирования, подобные Google, в которых загрузчики используют поисковую оптимизацию своих видео. Кроме того, видео на Youtube варьируются от разных категорий.
Facebook, однако, использует свой собственный алгоритм, похожий на социальные сети, для представления видео своим пользователям, и, следовательно, срок годности таких видео не намного по сравнению со сроком годности на Youtube. Платформа также фокусируется на «шоу», ориентированных на сообщество, а не на одном или двух видеороликах от независимых издателей
. Кроме того, то, как компания определяет «просмотр», также отличается. Чтобы считаться «просмотром», видео на YouTube должно получить фактический клик по ним (видео с автоматическим воспроизведением не получают просмотров). Даже для рекламы на YouTube их нужно воспроизводить в течение 30 секунд, чтобы получить «просмотр». В то время как Facebook считает, что видео получает «просмотр», даже если видео воспроизводится автоматически и воспроизводится в течение 3 секунд.
Кроме того, то, как компания определяет «просмотр», также отличается. Чтобы считаться «просмотром», видео на YouTube должно получить фактический клик по ним (видео с автоматическим воспроизведением не получают просмотров). Даже для рекламы на YouTube их нужно воспроизводить в течение 30 секунд, чтобы получить «просмотр». В то время как Facebook считает, что видео получает «просмотр», даже если видео воспроизводится автоматически и воспроизводится в течение 3 секунд.
Конкуренты Facebook в разных странах
Несмотря на то, что Facebook доминирует в мире, когда дело доходит до социальных сетей, есть еще много стран, которые он не смог завоевать. Ниже приведены некоторые конкуренты Facebook в регионах.
WeChat — это экосистема социальных сетей Китая. Под экосистемой мы подразумеваем, что это похоже на Facebook с дополнительными функциями. Заказывать еду, отправлять и получать деньги, делать покупки, оплачивать коммунальные услуги и регистрироваться на рейсы можно с помощью всего одного приложения.
Это то, к чему стремится Facebook в долгосрочной перспективе. Следовательно, это считается большой конкуренцией для Facebook, поскольку WeChat уже имеет более 1 миллиарда активных пользователей по всему миру.
WeChat против Facebook
WeChat — единственная платформа, которая имеет больше возможностей, чем Facebook. Он предлагает функции социальных сетей, такие как «Моменты» (например, стена Facebook) и «Люди рядом». Но помимо этого, он также предоставляет своим пользователям новости и развлекательные статьи, действует как платформа электронной коммерции и даже имеет возможность размещать мини-программы (приложения внутри приложений, например игры), которых нет в приложении Facebook.
ВКонтактеВКонтакте (ВК) имеет очень похожие функции и те же цели, что и Facebook. Его можно считать российским Facebook из-за его сходства и доминирования на российском рынке.
ВКонтакте является второй по популярности социальной платформой в России с более чем 300 млн зарегистрированных пользователей и 85 млн активных пользователей. Для сравнения, у Facebook около 8 миллионов активных пользователей.
Для сравнения, у Facebook около 8 миллионов активных пользователей.
ВКонтакте против Facebook
Хотя функции ВКонтакте очень похожи на Facebook, Facebook по-прежнему пользуется большей популярностью во всем мире.
Что касается безопасности учетной записи, ВКонтакте не соответствует критериям. В результате было взломано около 100 миллионов аккаунтов ВКонтакте, а личная информация опубликована в даркнете. В то время как учетные записи Facebook практически невозможно взломать.
Facebook позволяет пользователям добавлять профили и подробности о своей жизни столько, сколько они считают нужным. Находясь в ВК, нужна более подробная информация, которую легко смогут просмотреть люди из той же школы или с таким же интересом, местом рождения и т. д.
Еще одним отличием является функция прослушивания и обмена музыкой. ВКонтакте позволяет пользователю слушать и сохранять музыку в автономном режиме со всего мира, что невозможно на Facebook.
Подведем итоги
Facebook, хотя и приобрел всемирную популярность, по-прежнему стремится стать лучше, регулярно добавляя новые функции. На каждом шагу доказывает, что является жестким конкурентом, сохраняющим способность доминировать на рынке.
На каждом шагу доказывает, что является жестким конкурентом, сохраняющим способность доминировать на рынке.
Давай, расскажи нам, что ты думаешь!
Мы что-то пропустили? Ну давай же! Расскажите нам, что вы думаете о нашей статье о конкурентах Facebook в разделе комментариев
Prinona Das
Чтение всегда было моим хобби, но писательство стало моей страстью. Я люблю пробовать и узнавать новое с большим интересом
Услуги Aadhaar по SMS — Уникальный орган идентификации Индии
Уникальный орган идентификации Индии (UIDAI ввел услугу под названием «Услуги Aadhaar по SMS» , который позволяет владельцам номеров Aadhaar, у которых нет доступа к Интернету/резидентному порталу/m-Aadhaar и т. д., использовать различные услуги Aadhaar, такие как генерация/извлечение виртуального идентификатора, блокировка/разблокировка Aadhaar, биометрическая блокировка/разблокировка и т. д. через SMS.
Резидент может воспользоваться этими Услугами Aadhaar, отправив SMS с зарегистрированного мобильного телефона на номер 1947 в указанном ниже формате:
Для создания виртуального идентификатора
GVID
Например, если номер Aadhaar 1234-5678-9123, тогда
SMS – GVID 9123 и отправьте его на 1947
Для получения – виртуальный идентификатор
-SP-ARVID -Дигиты
Например, если номер AADHAAR составляет 1234-5678-9123, то
SMS- RVID 9123 и отправьте его на 1947
TO get OTP
, если используйте номер AADHAAR: . -NUMBER-последние-4-цифры
-NUMBER-последние-4-цифры
Например, если номер Aadhaar 1234-5678-9123, тогда
SMS – GETOTP 9123 и отправьте его на 1947
При использовании виртуального идентификатора: GETOTP<ПРОБЕЛ>Виртуальный идентификатор-номер-последние 6 цифр
Например, если виртуальный идентификатор 1234-1234-1234-9123, тогда
SMS – GETOTP 340123 и отправьте его на 1947
Для блокировки Aadhaar
2 SMS необходимо отправить для этой услуги.
SMS 1 : GETOTP
SMS 2 : LOCKUID<ПРОБЕЛ>НОМЕР Aadhaar-последние 4 цифры<ПРОБЕЛ>OTP-6 цифр
Например, если номер Aadhaar 1234-5678-9123, то
SMS – 2GETOTP и отправьте 913 Это в 1947 г.
Если предположим, что вы получаете OTP как «012345», затем
SMS — Lockuid 9123 012345 Отправьте его в 1947
Примечание:
(1) . должен быть предварительно сгенерирован, иначе вам не будет разрешено заблокировать
2) В случае нескольких зависимых номеров Aadhaar, связанных с одним и тем же номером мобильного телефона, и когда последние 4 цифры номеров Aadhaar одинаковы как минимум для 2 иждивенцев, второе SMS должно быть отправлено как:
LOCKUID
Чтобы разблокировать Aadhaar
Для этой услуги необходимо отправить 2 SMS.
SMS 1: GETOTP
SMS 2: UNLOCKUID
Например, если виртуальный ID 1234-1234-1234-9123, тогда
SMS – GETOTP 9123 и отправьте его на 1947
Если вы получили OTP как «012345», то
SMS – UNLOCKUID 349123 012345 и отправьте его на 1947
(2) В случае нескольких номеров Aadhaar, связанных с одним и тем же номером мобильного телефона, и когда последние 6 цифр виртуальных идентификаторов принадлежат как минимум 2 иждивенцам, второе SMS должно быть отправлено как:
UNLOCKUID
Чтобы активировать биометрическую блокировку
Для этой услуги необходимо отправить 2 SMS.
В случае использования номера Aadhaar —
SMS 1: GETOTP
SMS 2: ENABLEBIOLOCK
Например, если номер Aadhaar 1234-5678-9123, тогда
SMS – GETOTP 9123 и отправить на номер 1947
Если вы получили OTP как «012345», то
SMS – ENABLEBIOLOCK 9123 012345 и отправить на номер 1947
Если используется SMS 1: GETOTP
SMS 2: ENABLEBIOLOCK
Например если виртуальный ID 1234-1234-1234-9123 то
SMS – GetOTP 340123 и отправьте его в 1947
, если предположим, что вы получаете OTP как «012345», затем
SMS — EnableBiolock 349123 012345 и отправить его в 1947
: IFER. , то эта услуга не может быть предоставлена. быть отправлено как
, то эта услуга не может быть предоставлена. быть отправлено как
ENABLEBIOLOCK
(3) В случае нескольких зависимых номеров Aadhaar, связанных с одним и тем же номером мобильного телефона, и когда последние 6 цифр виртуального Идентификаторы одинаковы как минимум для 2 иждивенцев, затем следует отправить второе SMS:
ENABLEBIOLOCK
Для отключения биометрической блокировки
Для этого объекта необходимо отправить 2 SMS.
В случае использования номера Aadhaar —
SMS 1: GETOTP
SMS 2: DISABLEBIOLOCK
Например, если номер Aadhaar 1234-5678-9123, тогда
SMS – GETOTP 9123 и отправьте его на 1947
Если предположим, что вы получили OTP как «012345», тогда
– DISABLEBIOLOCK 9123 012345 и отправить на 1947
В случае использования виртуального идентификатора —
SMS 1: GETOTP
SMS 2: DISABLEBIOLOCK
Например, если виртуальный идентификатор 1234-1234-1234-9123, тогда
SMS – GETOTP 340123 и отправьте его на 1947
Если предположим, что вы получили OTP как «012345», тогда
SMS – DISABLEBIOLOCK 349123 012345 и отправить на номер 1947
Примечание:
(1) Если Aadhaar заблокирован, воспользоваться этой услугой будет нельзя.
(2) В случае нескольких зависимых номеров Aadhaar, связанных с одним и тем же номером номер Aadhaar одинаков как минимум для 2 иждивенцев, затем второе SMS должно быть отправлено как:
DISABLEBIOLOCK
(3) In в случае нескольких зависимых номеров Aadhaar, связанных с одним и тем же номером мобильного телефона, и когда последние 6 цифр виртуального идентификатора одинаковы как минимум для 2 иждивенцев, второе SMS должно быть отправлено как:
DISABLEBIOLOCK
Для временной разблокировки биометрии
Для этой возможности необходимо отправить 2 SMS.
В случае использования номера Aadhaar —
SMS 1: GETOTP
SMS 2: UNLOCKBIO
Например, если номер Aadhaar 1234-5678-9123, затем
SMS – GETOTP 9123 и отправьте его на номер 1947
Если вы получили одноразовый пароль как «012345», то
SMS – UNLOCKBIO 9123 012345 и отправьте его на номер 19032 9032
Виртуальный ID, если используется 19032 90 90 —
SMS 1: GETOTP
SMS 2: UNLOCKBIO
Например, если виртуальный идентификатор 1234-1234-1234-9123, то
SMS – GetOTP 340123 и отправьте его в 1947
, если предположим, что вы получаете OTP как «012345», затем
SMS — Unlockbio 349123 012345 и отправить его на 1947
.

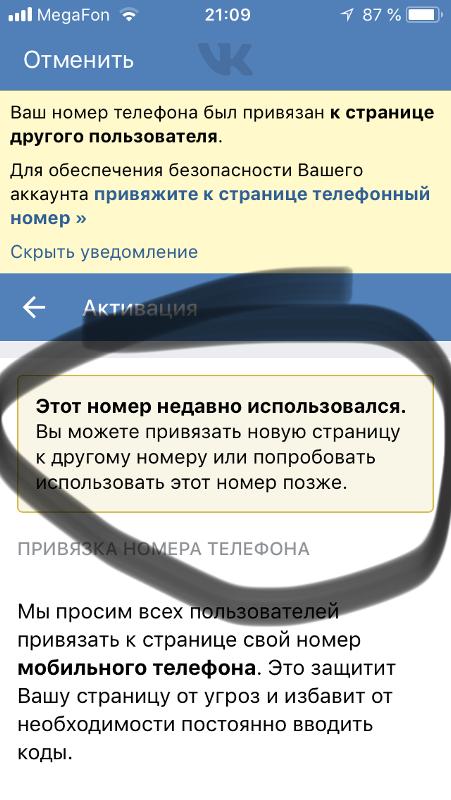 При исчерпании лимита возникнут затруднения с использованием контакта в очередном профиле.
При исчерпании лимита возникнут затруднения с использованием контакта в очередном профиле.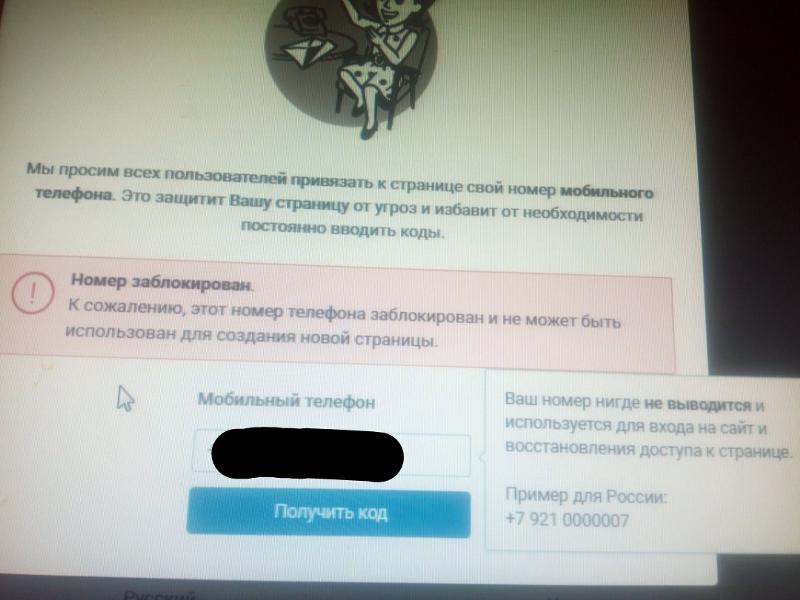
 Кликнуть «Продолжить».
Кликнуть «Продолжить».


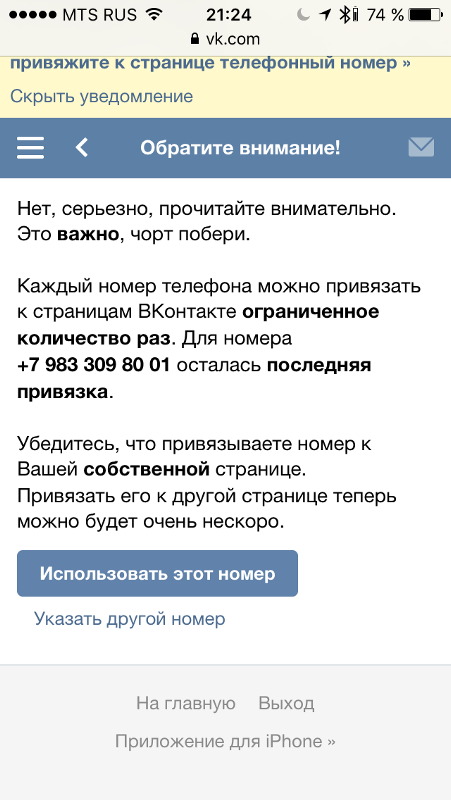
 Как создать второй профиль Вконтакте
Как создать второй профиль Вконтакте